题目内容
(2006?南通)我市濒临渤海,有较长的海岸线,海洋资源十分丰富.(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、______、______可制得精盐.
(2)晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,右图是它们的溶解度曲线示意图.
①设t1℃时MgCl2、KCl和MgSO4三种物质的溶解度分别为a、b、c,则它们的大小关系为______.
②将卤水加热到t2℃以上,根据溶解度曲线,首先析出的晶体是______.
(3)目前世界上60%的镁是从海水中提取的.其主要步骤如下:

①提取Mg的过程中,试剂A可以选用______,试剂B选用______.
②分离出Mg(OH)2后的NaCl溶液中还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了除去______;加入过量Na2CO3溶液的目的是______.
(4)目前海水淡化普遍采用“多级闪急蒸馏法”,证明蒸馏得到的水为淡水的方法是______
______.海底矿产资源“可燃冰”,其主要成分是水合甲烷晶体(CH4?nH2O),若水合甲烷晶体中CH4的质量分数为10%,则水合甲烷晶体的化学式为______.

【答案】分析:(1)根据粗盐提纯的步骤来解答;
(2)根据溶解度曲线所表示的意义来解答该题;
(3)①根据反应后得到是氢氧化镁沉淀,所以可以知道A的组成;
②除去硫酸根离子常用钡离子,除去钙离子常用碳酸根离子;
(4)根据海水及淡水的组成可以得出检验方法;通过计算可以得出n的值.
解答:解:(1)粗盐中含有泥沙,故应该先溶解然后再过滤而得到澄清溶液,最后蒸发结晶即可;
(2)①溶解度曲线表示的是溶质在某一温度下溶质的溶解度,故可以判断在t1℃时氯化镁的溶解度最大,而硫酸镁和氯化钾的溶解度相等;
②在t2℃时硫酸镁的溶解度出现了拐点,即随着温度升高而降低,故硫酸镁要析出晶体;
(3)①根据反应后生成的物质为氢氧化镁,可以知道A为氢氧化钠;
②钡离子可以和硫酸根反应生成沉淀,而碳酸根离子可以把过量的钡离子转化为沉淀,同时能够和钙离子结合生成沉淀;
(4)海水中含有氯离子,而淡化之后没有氯离子,故可以通过检验氯离子的存在来判断,检验氯离子常用硝酸银,可以据此来设计实验解答;根据元素的质量分数的求法可以得出: ×100%=10%,解得n=8.
×100%=10%,解得n=8.
故答案为:(1)过滤;蒸发;
(2)①a>b=c;
②MgSO4;
(3)①氢氧化钠或氢氧化钙; 盐酸;
②Na2SO4 除去CaCl2和过量的BaCl2;
(4)取样并滴加AgNO3溶液,若没有白色沉淀,说明蒸馏海水为淡水;CH4?8H2O.
点评:熟练掌握硫酸根离子、碳酸根离子等离子的检验和除杂,除杂时要注意所加试剂是否需要过量,且最后还需要考虑过量的试剂是否需要除去.
(2)根据溶解度曲线所表示的意义来解答该题;
(3)①根据反应后得到是氢氧化镁沉淀,所以可以知道A的组成;
②除去硫酸根离子常用钡离子,除去钙离子常用碳酸根离子;
(4)根据海水及淡水的组成可以得出检验方法;通过计算可以得出n的值.
解答:解:(1)粗盐中含有泥沙,故应该先溶解然后再过滤而得到澄清溶液,最后蒸发结晶即可;
(2)①溶解度曲线表示的是溶质在某一温度下溶质的溶解度,故可以判断在t1℃时氯化镁的溶解度最大,而硫酸镁和氯化钾的溶解度相等;
②在t2℃时硫酸镁的溶解度出现了拐点,即随着温度升高而降低,故硫酸镁要析出晶体;
(3)①根据反应后生成的物质为氢氧化镁,可以知道A为氢氧化钠;
②钡离子可以和硫酸根反应生成沉淀,而碳酸根离子可以把过量的钡离子转化为沉淀,同时能够和钙离子结合生成沉淀;
(4)海水中含有氯离子,而淡化之后没有氯离子,故可以通过检验氯离子的存在来判断,检验氯离子常用硝酸银,可以据此来设计实验解答;根据元素的质量分数的求法可以得出:
 ×100%=10%,解得n=8.
×100%=10%,解得n=8.故答案为:(1)过滤;蒸发;
(2)①a>b=c;
②MgSO4;
(3)①氢氧化钠或氢氧化钙; 盐酸;
②Na2SO4 除去CaCl2和过量的BaCl2;
(4)取样并滴加AgNO3溶液,若没有白色沉淀,说明蒸馏海水为淡水;CH4?8H2O.
点评:熟练掌握硫酸根离子、碳酸根离子等离子的检验和除杂,除杂时要注意所加试剂是否需要过量,且最后还需要考虑过量的试剂是否需要除去.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
(2006?南通模拟)在一节化学实验探究课上,张老师拿出两瓶无标签的试剂,分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体.我们对此气体展开了一系列探究:
(1)我猜想此气体是.
(2)验证它的实验方案如下:
产生此气体的化学方程式可能是(3)我想制取该气体,采用的发生装置可选取下图中的(填序号),收集装置是.
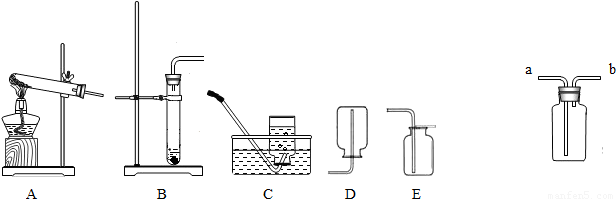
(4)如用图装置收集该气体,气体由端(填“a”或“b”)导入.
(1)我猜想此气体是.
(2)验证它的实验方案如下:
| 现象及结论 | |

(4)如用图装置收集该气体,气体由端(填“a”或“b”)导入.

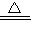 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O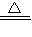 NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O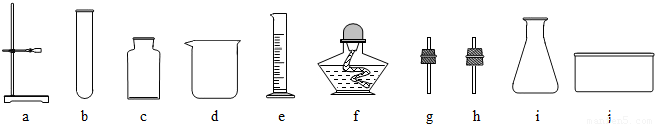
 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O