题目内容
将20g不纯的硫酸铜样品(杂质不溶于水,也不参加反应)跟一定量的氢氧化钠溶液恰好完全反应,得到溶质质量分数为20%的溶液71g.求:
(1)样品中硫酸铜的质量分数;
(2)加入氢氧化钠溶液的溶质质量分数.(保留一位小数)
解:溶质质量分数为20%的硫酸钠溶液71g中含硫酸钠的质量=71g×20%=14.2g
设样品中硫酸铜的质量为x,氢氧化钠溶液中氢氧化钠的质量为y,反应生成氢氧化铜的质量为z
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
160 80 98 142
x y z 14.2g
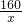 =
=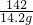 x=16g
x=16g
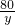 =
=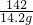 y=8g
y=8g
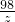 =
=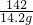 z=9.8g
z=9.8g
样品中硫酸铜的质量分数=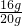 ×100%=80%
×100%=80%
加入氢氧化钠溶液的溶质质量分数= ×100%=12.3%
×100%=12.3%
答:(1)样品中硫酸铜的质量分数为80%;(2)加入氢氧化钠溶液的溶质质量分数为12.3%.
分析:硫酸铜与一定量的氢氧化钠溶液恰好完全反应,所得溶液为硫酸钠溶液,根据得到溶质质量分数为20%的溶液71g计算出反应生成硫酸钠的质量,根据反应的化学方程式,由硫酸钠的质量可计算样品中硫酸铜的质量及所消耗氢氧化钠溶液中氢氧化钠的质量;
(1)样品中硫酸铜的质量分数= ×100%;
×100%;
(2)加入氢氧化钠溶液的溶质质量分数= ×100%,其中氢氧化钠溶液的质量可利用质量守恒定律求得.
×100%,其中氢氧化钠溶液的质量可利用质量守恒定律求得.
点评:根据质量守恒定律,所加入氢氧化钠溶液的质量=反应后所得硫酸钠溶液的质量+生成沉淀氢氧化铜的质量-硫酸铜的质量.
设样品中硫酸铜的质量为x,氢氧化钠溶液中氢氧化钠的质量为y,反应生成氢氧化铜的质量为z
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
160 80 98 142
x y z 14.2g
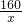 =
=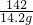 x=16g
x=16g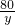 =
=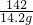 y=8g
y=8g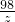 =
=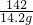 z=9.8g
z=9.8g样品中硫酸铜的质量分数=
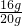 ×100%=80%
×100%=80%加入氢氧化钠溶液的溶质质量分数=
 ×100%=12.3%
×100%=12.3%答:(1)样品中硫酸铜的质量分数为80%;(2)加入氢氧化钠溶液的溶质质量分数为12.3%.
分析:硫酸铜与一定量的氢氧化钠溶液恰好完全反应,所得溶液为硫酸钠溶液,根据得到溶质质量分数为20%的溶液71g计算出反应生成硫酸钠的质量,根据反应的化学方程式,由硫酸钠的质量可计算样品中硫酸铜的质量及所消耗氢氧化钠溶液中氢氧化钠的质量;
(1)样品中硫酸铜的质量分数=
 ×100%;
×100%;(2)加入氢氧化钠溶液的溶质质量分数=
 ×100%,其中氢氧化钠溶液的质量可利用质量守恒定律求得.
×100%,其中氢氧化钠溶液的质量可利用质量守恒定律求得.点评:根据质量守恒定律,所加入氢氧化钠溶液的质量=反应后所得硫酸钠溶液的质量+生成沉淀氢氧化铜的质量-硫酸铜的质量.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
 (2013?盐城二模)请你参与某学习小组的探究活动,并回答相关问题.
(2013?盐城二模)请你参与某学习小组的探究活动,并回答相关问题.