题目内容
【题目】我校化学兴趣小组同学为了测定当地石灰石中碳酸钙的质量分数,他们采用的方法如下:取该石灰石样品16g,把80g稀盐酸分四次加入,测量过程所得数据见下表(杂质不和盐酸反应,也不溶与水),请帮他们计算:
序号 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
第1次 | 20 | 11 |
第2次 | 20 | 6 |
第3次 | 20 | 2.8 |
第4次 | 20 | n |
(1)碳酸钙的相对分子质量 _______。
(2)上表中n的数值是 _________ 。
(3)样品中碳酸钙的质量分数 _________ 。
(4)生成二氧化碳的质量为__________(写出计算过程)。
【答案】100 2.8 82.5% 5.808g
【解析】
本题考查相对分之质量,质量分数,化学方程式的书写,根据化学方程式的简单计算
(1) 碳酸钙的相对分子质量=40×1+12×1+16×3=100
(2)有表可知,石灰石样品16g,第1次反应完剩余固体11g,反应完16g-11g=4g碳酸钙,而第2次与第3次,只反应完6g-2.8g=3.2g碳酸钙,说明第2次与第3次盐酸过量,所以,2.8g为杂质质量,故n=2.8g
(3)由(2)可知杂质质量为2.8g,所以,碳酸钙质量为16g-2.8g=13.2g,故)样品中碳酸钙的质量分数=![]()
(4)解:设生成二氧化碳质量为x
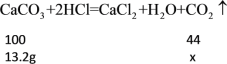
![]()
![]()
答:生成二氧化碳的质量为5.808g

练习册系列答案
相关题目
【题目】为达到下列实验目的,相应的实验方案合理的是
实验目的 | 实验方案 | |
A | 除去一氧化碳中少量的二氧化碳 | 将气体通过灼热氧化铜 |
B | 除去氧化铜中混有的碳 | 隔绝空气加强热 |
C | 鉴别氢气和甲烷 | 分别点燃,在火焰上方罩干冷烧杯 |
D | 鉴别二氧化碳和氮气 | 把气体分别通入澄清石灰水中 |
A. A B. B C. C D. D