题目内容
小明同学在实验室发现一瓶敞口放置的NaOH固体,他对这瓶NaOH固体的变质情况进行了如下实验探究.
(1)取少量固体于试管中,滴加稀盐酸,有气泡产生,由此可知该NaOH固体确实已经变质.请你写出氢氧化钠在空气中变质的化学方程式
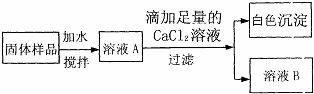
(2)该同学为进一步探究固体中是否还含有NaOH,设计了如下实验方案:
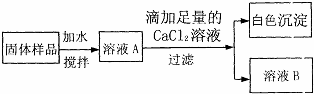
①滴加足量的CaCl2溶液目的是
②取少量溶液B于试管中,滴加少量
(3)如果经验证只有少量一部分NaOH变质,除去杂质,应加入的试剂是
(1)取少量固体于试管中,滴加稀盐酸,有气泡产生,由此可知该NaOH固体确实已经变质.请你写出氢氧化钠在空气中变质的化学方程式
2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O
.(2)该同学为进一步探究固体中是否还含有NaOH,设计了如下实验方案:

①滴加足量的CaCl2溶液目的是
除尽溶液中的碳酸钠(或CO32-)
除尽溶液中的碳酸钠(或CO32-)
,生成沉淀的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
.②取少量溶液B于试管中,滴加少量
无色酚酞
无色酚酞
试液,现象为变红(或不变色)
变红(或不变色)
,其结论是固体样品中存在(或不存在)
存在(或不存在)
(填“存在”或“不存在”)氢氧化钠.(3)如果经验证只有少量一部分NaOH变质,除去杂质,应加入的试剂是
澄清石灰水
澄清石灰水
,反应的化学方程式是Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
.分析:本题是对敞口放置的NaOH固体变质情况的实验探究,变质的原因主要是碱与二氧化碳发生了化学反应.
(1)对于固体加酸有气体产生,说明已变质.
(2)探究固体中是否还含有NaOH,因为碳酸钠溶液也显碱性,故要先排除碳酸钠的干扰;然后根据溶液中加酚酞的颜色变化来判断氢氧化钠的存在.
(3)根据碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠进行解答.
(1)对于固体加酸有气体产生,说明已变质.
(2)探究固体中是否还含有NaOH,因为碳酸钠溶液也显碱性,故要先排除碳酸钠的干扰;然后根据溶液中加酚酞的颜色变化来判断氢氧化钠的存在.
(3)根据碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠进行解答.
解答:解:(1)在空气中变质是和二氧化碳发生了化学反应,化学方程式为:2NaOH+CO2=Na2CO3+H2O;
(2)①足量的CaCl2溶液可将碳酸钠全部反应掉,滴加足量的CaCl2溶液目的是:除尽溶液中的碳酸钠(或(CO32-);生成沉淀的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl;
②因酚酞遇碱变红色,若还有氢氧化钠,加酚酞溶液变红,反之,不变红;
(3)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,除去杂质,应加入的试剂是澄清石灰水;反应的化学方程式是Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
故答案为:(1)2NaOH+CO2=Na2CO3+H2O;
(2)①除尽溶液中的碳酸钠(或CO32-);CaCl2+Na2CO3=CaCO3↓+2NaCl;
②无色酚酞;变红(或不变色);存在(或不存在);
(3)澄清石灰水; Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(2)①足量的CaCl2溶液可将碳酸钠全部反应掉,滴加足量的CaCl2溶液目的是:除尽溶液中的碳酸钠(或(CO32-);生成沉淀的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl;
②因酚酞遇碱变红色,若还有氢氧化钠,加酚酞溶液变红,反之,不变红;
(3)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,除去杂质,应加入的试剂是澄清石灰水;反应的化学方程式是Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
故答案为:(1)2NaOH+CO2=Na2CO3+H2O;
(2)①除尽溶液中的碳酸钠(或CO32-);CaCl2+Na2CO3=CaCO3↓+2NaCl;
②无色酚酞;变红(或不变色);存在(或不存在);
(3)澄清石灰水; Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
点评:通过本题学生要明确分析成分,主要是分析可能发生的化学反应,应熟悉物质之间的相互反应及现象.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【提出问题】小明同学在实验室发现一瓶没有标签的橙色液体,出于好奇,他用一只洁净的试管取了约2mL氢氧化钠溶液,然后滴加了几滴该橙色液体,结果溶液变黄色.小明想,为什么溶液会发生颜色变化呢?
【建立假设】小明想,这种物质可能是一种酸碱指示剂.
【收集证据】一般情况下,能在酸或碱溶液中显示不同颜色的物质,可作酸碱指示剂.请你设计一个简单的探究方案,证明小明的猜想.
| 实验操作方法和过程 | 观察到的现象 |
【交流反思】通过以上探究活动,你得到的启示是________________.