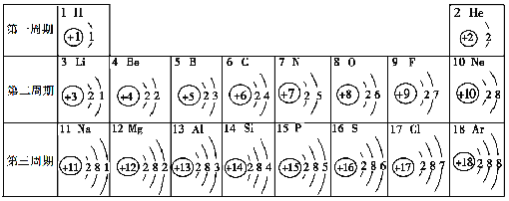
题目内容
【题目】酸和碱是初中化学重要的化合物
⑴将①浓盐酸、②浓硫酸、③NaOH 溶液、④Ca(OH)2 溶液、⑤NaCl 溶液分别敞口放置在空气 中,一段时间后,溶液质量增加的是______(填序号).
⑵欲将 50g 溶质质量质量分数为 98%的浓硫酸稀释成 19.6%的稀盐酸,需要加水_____g,请 简述稀释浓硫酸的正确操作.____________
⑶用 NaOH 固体配制 50g 质量分数为 10%的 NaOH 溶液制作“叶脉书签”,所需的玻璃仪器 有___________,量取水时若仰视读数,会使得到的溶液中溶质质量分数____________(填“偏大”、“偏小”或“不变”)
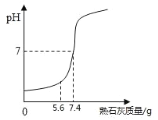
⑷为中和实验后废液中含有的盐酸,取 100g 废液向其中加入熟石灰,反应过程中溶液的 pH 随加入熟石灰质量的变化关系如图所示.
①请根据图示计算废液中盐酸的质量分数____________.
②当加入 5.6g 熟石灰时,溶液中的溶质有______,若改用 7.4g 氢氧化钠与相同量的废液反 应,反应后所得溶液的 pH______7(填“>”,“<”或“=”).
【答案】 ②③ 200 将浓硫酸沿着烧杯壁缓缓倒入到水中,同时用玻璃棒不断搅拌. 烧杯,玻璃棒,量筒,胶头滴管; 偏小 7.3% CaCl2、HCl <
【解析】
(1)浓盐酸具有挥发性,敞口放置一段时间溶液的质量会减少,浓硫酸具有吸水性,敞口放置一段时间溶液的质量会增加,氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水,溶液的质量会增加,氢氧化钙能和空气中的二氧化碳反应生成碳酸钙沉淀和水,溶液的质量会减少,氯化钠溶液敞口放置一段时间溶液的质量无明显变化,所以溶液质量增加的是②③;(2)浓硫酸的在稀释的过程中溶质的质量没有发生改变,假设稀释之后溶液的质量为x,则有![]() ,
,![]() ,所以加入水的质量为
,所以加入水的质量为![]() ,稀释浓硫酸的正确操作是将浓硫酸沿着烧杯壁缓缓倒入到水中,同时用玻璃棒不断搅拌;(3)配制溶液所需要的玻璃仪器有烧杯、玻璃棒、量筒和胶头滴管,用量筒量取液体仰视读数会使量取的水偏多,则溶质的质量分数偏小;(4)当加入7.4g氢氧化钙时恰好完全反应,根据氢氧化钙的质量和反应的化学方程式可以求出盐酸的质量分数。
,稀释浓硫酸的正确操作是将浓硫酸沿着烧杯壁缓缓倒入到水中,同时用玻璃棒不断搅拌;(3)配制溶液所需要的玻璃仪器有烧杯、玻璃棒、量筒和胶头滴管,用量筒量取液体仰视读数会使量取的水偏多,则溶质的质量分数偏小;(4)当加入7.4g氢氧化钙时恰好完全反应,根据氢氧化钙的质量和反应的化学方程式可以求出盐酸的质量分数。
解:设废液中盐酸的质量为x
2HCl+Ca(OH)2=CaCl2+2H2O
73 74
x 7.4g
![]()
![]()
![]()
答:废液中盐酸的质量分数为7.3%。
当加入5.6g熟石灰时溶液中发生了2HCl+Ca(OH)2=CaCl2+2H2O的反应,所以溶液中的溶质有CaCl2和没有反应完的HCl,若改用氢氧化钠和相同的废液反应,则中和同样的盐酸需要氢氧化钠的质量为8g,加入7.4g氢氧化钠不能把所有的盐酸中和,盐酸有剩余,所以溶液呈酸性,溶液的pH小于7。

 阅读快车系列答案
阅读快车系列答案【题目】曾有一段时间在微信上流传了一种懒人火锅。这种火锅分上下两层,食用前只需要把带底料的食材放入上层,然后将加热包放入下层,并加入一定量冷水,立即就能产生热量给上层的食材加热,使汤料沸腾,并保温1到2个小时。某化学兴趣小组对这种懒人火锅的原理及使用后加热包中的成分进行了研究。

(查阅资料)发热包的主要成分是:碳酸钠、焙烧硅藻土(难溶于水)、铁粉、焦炭粉、活性炭、氯化钠、生石灰。
(实验探究)
(1)同学甲经过对发热包成分的研究后,认为发热主要原理是________(用化学方程式表示)
(2)同学乙从已经使用完的发热包中取少量固体混合物于烧杯中,缓慢加入足量蒸馏水,边加边搅拌,静置,过滤得滤液。
(3)同学丙在上述实验的基础上,对滤液中所含阴离子的种类进行探究,请帮她完成实验过程。提供的试剂:稀盐酸、稀硝酸、酚酞、AgNO3溶液、Ba(NO3)2溶液、Mg(NO3)2溶液
实验操作 | 预期现象 | 结论 |
步骤1:取少量滤液于试管中,加入_______。 | _______ | 滤液中没有CO32- |
步骤2:另取少量滤液于试管中,加入过量_____。 | _________ | 滤液中含有OH- |
步骤3:_________ | 产生白色沉淀 | 滤液中含有______ |