题目内容
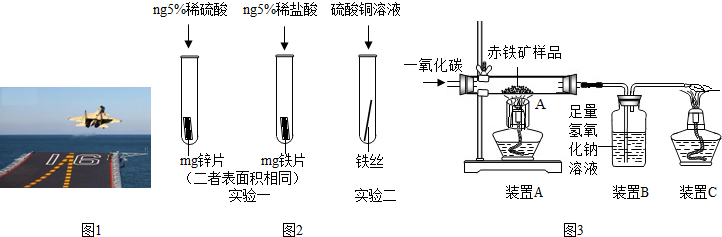
金属材料在国防建设中起着重要的作用,如图1为歼-15飞机在辽宁舰上起飞.
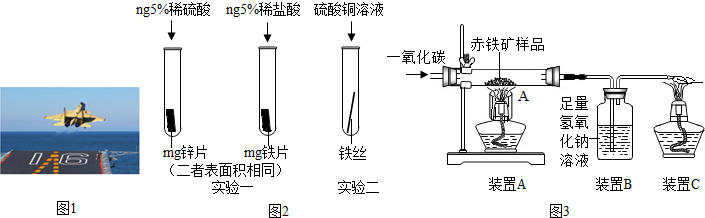
(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是
(2)改装前的辽宁舰舰身锈迹斑斑,钢铁的锈蚀主要是铁与空气中的
(3)为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强金属.小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是
②实验二中,若出现
(4)辽宁舰的建造耗费了大量的钢材.某兴趣小组在实验室用图3所示装置模拟炼铁的化学原理,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,CO2被充分吸收,氧化铁反应完全且赤铁矿中的杂质不参加反应,称重赤铁矿样品的质量为Wg).
①装置A中生成铁的化学方程式为
②要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是
③设计实验证明锌、铁、铜三种金属的金属活动性强弱,要求写出实验步骤、现象和结论.

(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是
硬度大、密度小
硬度大、密度小
.(2)改装前的辽宁舰舰身锈迹斑斑,钢铁的锈蚀主要是铁与空气中的
氧气与水蒸气
氧气与水蒸气
共同作用的结果.铁锈的成分主要是Fe2O3?xH2O
Fe2O3?xH2O
(填化学式).(3)为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强金属.小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是
所用酸的种类不同
所用酸的种类不同
.②实验二中,若出现
铁丝表面附着红色固体
铁丝表面附着红色固体
现象,可证明铁的活动性强于铜,该反应的化学方程式为Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
.(4)辽宁舰的建造耗费了大量的钢材.某兴趣小组在实验室用图3所示装置模拟炼铁的化学原理,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,CO2被充分吸收,氧化铁反应完全且赤铁矿中的杂质不参加反应,称重赤铁矿样品的质量为Wg).
①装置A中生成铁的化学方程式为
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
,装置C的作用是
| ||
将CO燃烧防止其污染空气
将CO燃烧防止其污染空气
.②要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是
装置A在反应前后的质量变化
装置A在反应前后的质量变化
或装置B在反应前后的质量变化
装置B在反应前后的质量变化
.③设计实验证明锌、铁、铜三种金属的金属活动性强弱,要求写出实验步骤、现象和结论.
| 实验步骤 | 实验现象 | 实验结论 |
分别取少量硫酸铜溶液、硫酸锌溶液于两支试管中,将铁丝分别浸入两溶液中,观察现象. 分别取少量硫酸铜溶液、硫酸锌溶液于两支试管中,将铁丝分别浸入两溶液中,观察现象. |
浸入硫酸铜溶液中的铁丝表面出现红色固体,溶液由蓝色逐渐变为浅绿色;浸入硫酸锌溶液的铁丝无明显变化. 浸入硫酸铜溶液中的铁丝表面出现红色固体,溶液由蓝色逐渐变为浅绿色;浸入硫酸锌溶液的铁丝无明显变化. |
金属活动性顺序: Zn>Fe>Cu 金属活动性顺序: Zn>Fe>Cu |
分析:(1)根据铝合金的性质分析;
(2)根据铁生锈的条件及锈的主要成分分析回答;
(3)①从控制变量的角度进行分析;
②根据铁与硫酸铜溶液反应的现象分析回答;
(4)①一氧化碳在高温下还原氧化铁生成铁和二氧化碳;根据一氧化碳能污染空气分析装置C的作用;
②由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.
③根据锌、铁、铜三种金属的活动性强弱关系为锌>铁>铜,要比较三种金属的活泼性的大小,采取“三取中”的方法,即取铁丝分别放入硫酸锌溶液和硫酸铜溶液,铁丝不能与硫酸锌溶液发生反应,说明铁的活动性不如锌强;铁丝能置换出硫酸铜中的铜,说明铁的活动性比铜强.
(2)根据铁生锈的条件及锈的主要成分分析回答;
(3)①从控制变量的角度进行分析;
②根据铁与硫酸铜溶液反应的现象分析回答;
(4)①一氧化碳在高温下还原氧化铁生成铁和二氧化碳;根据一氧化碳能污染空气分析装置C的作用;
②由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.
③根据锌、铁、铜三种金属的活动性强弱关系为锌>铁>铜,要比较三种金属的活泼性的大小,采取“三取中”的方法,即取铁丝分别放入硫酸锌溶液和硫酸铜溶液,铁丝不能与硫酸锌溶液发生反应,说明铁的活动性不如锌强;铁丝能置换出硫酸铜中的铜,说明铁的活动性比铜强.
解答:解:(1)因铝合金材质强度大、质量轻,所以铝合金可用于制造飞机的外壳;
(2)钢铁的锈蚀,实际上是铁跟水和氧气共同作用的结果;锈的主要成分是Fe2O3?xH2O.
(3)①从图可以看出选取的酸的种类不同,因此以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱不够合理;
②实验二中,若铁丝表面出现红色物质,可证明铁的活动性强于铜,该反应的化学方程式为:Fe+CuSO4═FeSO4+Cu;
(4)①一氧化碳在高温下还原氧化铁生成铁和二氧化碳,反应的化学方程式是:Fe2O3+3CO
2Fe+3CO2;由于一氧化碳能污染空气,所以装置C的作用是:将CO燃烧防止其污染空气.
②由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.所以,要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是装置A在反应前后的质量变化或装置B在反应前后的质量变化.
③由于锌、铁、铜三种金属的活动性强弱关系为锌>铁>铜,要比较锌、铁、铜三种金属的活动性强弱关系,常采用“三取中”的方法,即取两根光亮的铁丝,然后分别放入盛有硫酸锌和硫酸铜溶液的两支试管中,放入硫酸锌溶液的铁丝无明显变化,说明铁的活动性不如锌强;放入硫酸铜溶液的铁丝表面出现红色物质,说明铁的活动性比铜强.可以得出活动性由强到弱为锌>铁>铜.故实验方案如下:
故答案为:(1)强度大、质量轻;(2)氧气、水;Fe2O3?xH2O;(3)①选取的酸的种类不同;②铁丝表面出现红色物质;Fe+CuSO4═FeSO4+Cu;(4)Fe2O3+3CO
2Fe+3CO2;将CO燃烧防止其污染空气.②反应后装置A中药品的质量;测出反应前后装置B增加的质量. ③见上表.
(2)钢铁的锈蚀,实际上是铁跟水和氧气共同作用的结果;锈的主要成分是Fe2O3?xH2O.
(3)①从图可以看出选取的酸的种类不同,因此以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱不够合理;
②实验二中,若铁丝表面出现红色物质,可证明铁的活动性强于铜,该反应的化学方程式为:Fe+CuSO4═FeSO4+Cu;
(4)①一氧化碳在高温下还原氧化铁生成铁和二氧化碳,反应的化学方程式是:Fe2O3+3CO
| ||
②由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.所以,要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是装置A在反应前后的质量变化或装置B在反应前后的质量变化.
③由于锌、铁、铜三种金属的活动性强弱关系为锌>铁>铜,要比较锌、铁、铜三种金属的活动性强弱关系,常采用“三取中”的方法,即取两根光亮的铁丝,然后分别放入盛有硫酸锌和硫酸铜溶液的两支试管中,放入硫酸锌溶液的铁丝无明显变化,说明铁的活动性不如锌强;放入硫酸铜溶液的铁丝表面出现红色物质,说明铁的活动性比铜强.可以得出活动性由强到弱为锌>铁>铜.故实验方案如下:
| 实验步骤 | 实验现象 | 实验结论 |
| 分别取少量硫酸铜溶液、硫酸锌溶液于两支试管中,将铁丝分别浸入两溶液中,观察现象. | 浸入硫酸铜溶液中的铁丝表面出现红色固体,溶液由蓝色逐渐变为浅绿色;浸入硫酸锌溶液的铁丝无明显变化. | 金属活动性顺序: Zn>Fe>Cu |
| ||
点评:本题难度较大,综合性较强.掌握常见合金的优点、钢铁锈蚀的原理和除锈原理以及根据实验分析、解决问题方法是解决本题的关键.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目