题目内容
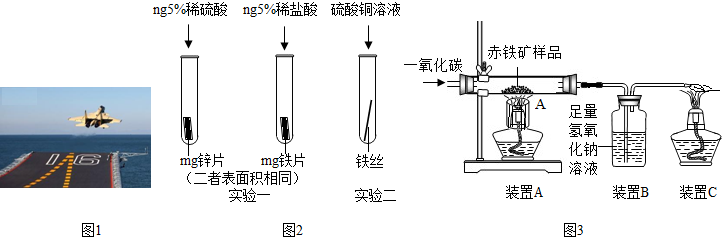
金属材料在国防建设中起着重要的作用,图1为歼-15飞机在辽宁舰上起飞.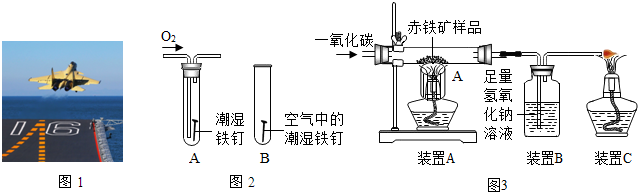
(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是 .
(2)改装前的辽宁舰舰身锈迹斑斑,钢铁锈蚀主是铁与空气中的 共同作用的结果,为了避免轮船钢质外壳被腐蚀,通常用 方法防锈.
(3)某小组用如图2所示装置对铁生锈的条件进行探究.一段时间后发现A中铁钉表面灰暗,B中铁钉依然光亮,对比A、B现象说明:决定铁生锈快慢的一个重要因素是 .
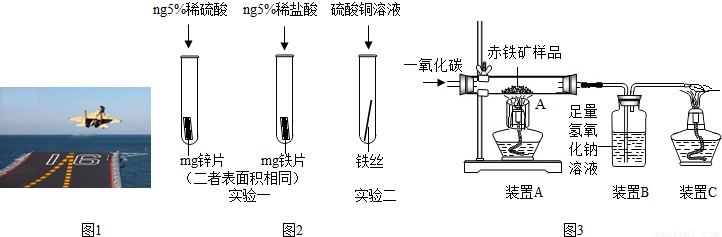
(4)工业生产常用10%的稀盐酸来除铁锈,写出除锈的化学方程式 .实验室用浓盐酸配制10%的稀盐酸时,用到的主要仪器有 .
(5)用如图3所示的装炼铁,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,反应完全且赤铁矿中的杂质不参加反应,称量赤铁矿样品的质量为wg).
①实验过程中的主要步骤有:a检验CO的纯度,通入一氧化碳;b装入药品并固定;c加热;d停止加热.其中正确的实验步骤是 .
②装置A中发生反应的方程式为 ;装置C的作用是 .
③要测定赤铁矿样品中氧化铁的质量分数,需要测量的数据是 .(填一种答案即可)

(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是
(2)改装前的辽宁舰舰身锈迹斑斑,钢铁锈蚀主是铁与空气中的
(3)某小组用如图2所示装置对铁生锈的条件进行探究.一段时间后发现A中铁钉表面灰暗,B中铁钉依然光亮,对比A、B现象说明:决定铁生锈快慢的一个重要因素是
(4)工业生产常用10%的稀盐酸来除铁锈,写出除锈的化学方程式
(5)用如图3所示的装炼铁,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,反应完全且赤铁矿中的杂质不参加反应,称量赤铁矿样品的质量为wg).
①实验过程中的主要步骤有:a检验CO的纯度,通入一氧化碳;b装入药品并固定;c加热;d停止加热.其中正确的实验步骤是
②装置A中发生反应的方程式为
③要测定赤铁矿样品中氧化铁的质量分数,需要测量的数据是
分析:(1)根据铝合金的性质分析;
(2)根据铁生锈的条件,为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌的金属活动性应比铁的活动性强,分析回答;
(3)对比A、B两图,就是空气与氧气的差别进行解答;
(4)铁锈的主要成分是氧化铁,它能与稀盐酸反应生成氯化铁和水;配制溶液所需要的仪器主要有量筒、烧杯、玻璃棒、胶头滴管;
(5)①根据实验室制氢气并使氢气跟灼热的氧化铜反应的步骤及注意事项,将下列步骤进行排序;
②一氧化碳在高温下还原氧化铁生成铁和二氧化碳;根据一氧化碳能污染空气分析装置C的作用;
③由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.
(2)根据铁生锈的条件,为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌的金属活动性应比铁的活动性强,分析回答;
(3)对比A、B两图,就是空气与氧气的差别进行解答;
(4)铁锈的主要成分是氧化铁,它能与稀盐酸反应生成氯化铁和水;配制溶液所需要的仪器主要有量筒、烧杯、玻璃棒、胶头滴管;
(5)①根据实验室制氢气并使氢气跟灼热的氧化铜反应的步骤及注意事项,将下列步骤进行排序;
②一氧化碳在高温下还原氧化铁生成铁和二氧化碳;根据一氧化碳能污染空气分析装置C的作用;
③由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.
解答:解:(1)因铝合金材质强度大、质量轻,所以铝合金可用于制造飞机的外壳;
(2)钢铁的锈蚀,实际上是铁跟水和氧气共同作用的结果;为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌锌板;
(3)对比A、B两图,就是空气与氧气的差别,所以决定铁生锈快慢的一个重要因素是氧气的浓度;
(4)铁锈的主要成分是氧化铁,它能与稀盐酸反应生成氯化铁和水,反应方程式为Fe2O3+6HCl=2FeCl3+3H2O;配制溶液所需要的仪器主要有量筒、烧杯、玻璃棒、胶头滴管;
(5)①氢气属于易燃性气体,不纯加热易爆炸,需要先检验其纯度才能用于实验,用氢气还原氧化铜时要先通入氢气以排出空气,然后加热,为防止生成的铜被氧化,实验结束要先停止加热,故为:bacd;
②一氧化碳在高温下还原氧化铁生成铁和二氧化碳,反应的化学方程式是:Fe2O3+3CO
2Fe+3CO2;由于一氧化碳能污染空气,所以装置C的作用是:将CO燃烧防止其污染空气.
③由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.所以,要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是装置A在反应前后的质量变化或装置B在反应前后的质量变化.
故答案为:(1)强度大、质量轻
(2)氧气和水;镶嵌锌板
(3)氧气的浓度
(4)Fe2O3+6HCl═2FeCl3+3H2O;量筒、烧杯、玻璃棒、胶头滴管
(5)①bacd;
②Fe2O3+3CO
2Fe+3CO2;将CO燃烧防止其污染空气
③反应后装置A中药品的质量(或测出反应前后装置B增加的质量).
(2)钢铁的锈蚀,实际上是铁跟水和氧气共同作用的结果;为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌锌板;
(3)对比A、B两图,就是空气与氧气的差别,所以决定铁生锈快慢的一个重要因素是氧气的浓度;
(4)铁锈的主要成分是氧化铁,它能与稀盐酸反应生成氯化铁和水,反应方程式为Fe2O3+6HCl=2FeCl3+3H2O;配制溶液所需要的仪器主要有量筒、烧杯、玻璃棒、胶头滴管;
(5)①氢气属于易燃性气体,不纯加热易爆炸,需要先检验其纯度才能用于实验,用氢气还原氧化铜时要先通入氢气以排出空气,然后加热,为防止生成的铜被氧化,实验结束要先停止加热,故为:bacd;
②一氧化碳在高温下还原氧化铁生成铁和二氧化碳,反应的化学方程式是:Fe2O3+3CO
| ||
③由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.所以,要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是装置A在反应前后的质量变化或装置B在反应前后的质量变化.
故答案为:(1)强度大、质量轻
(2)氧气和水;镶嵌锌板
(3)氧气的浓度
(4)Fe2O3+6HCl═2FeCl3+3H2O;量筒、烧杯、玻璃棒、胶头滴管
(5)①bacd;
②Fe2O3+3CO
| ||
③反应后装置A中药品的质量(或测出反应前后装置B增加的质量).
点评:本题难度较大,综合性较强.掌握常见合金的优点、钢铁锈蚀的原理和除锈原理以及根据实验分析、解决问题方法是解决本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目