题目内容
【题目】如图是实验室常用的部分实验装置,请按要求回答下列问题:
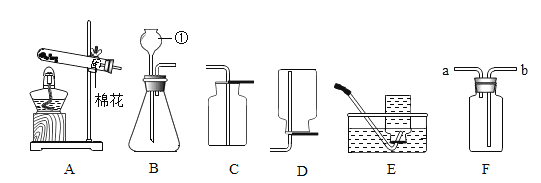
(1)写出标号①的仪器名称:_____。
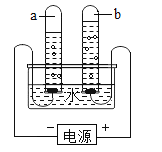
(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是_____(填字母),若用E装置收集氧气,当气泡_____时开始收集.
(3)实验室制取二氧化碳应选择的发生装置是_____(填字母),反应的化学方程式为_____;欲使用装置F收集CO2,则气体应从_____(选填“a”或 “b”)端通人。
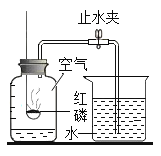
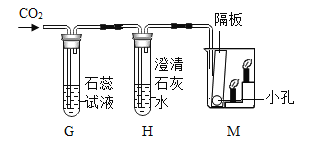
(4)另一组同学设计了如图所示的装置来验证二氧化碳的性质,当通入二氧化碳一段时间后,G装置中观察到的现象是_____;观察到M装置中蜡烛由低到高依次熄灭,说明二氧化碳具有_____的性质.
【答案】长颈漏斗 A 连续均匀冒出 B CaCO3+2HCl=CaCl2+H2O+CO2↑ b 紫色石蕊变红色 二氧化碳的密度比空气大,不能燃烧,不支持燃烧
【解析】
(1)据图可知①的仪器名称是长颈漏斗;
(2)如果用高锰酸钾制氧气就需要加热,应用发生装置A;用排水法收集较纯净氧气的适宜时间是:当导管口有连续均匀气泡冒出时;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热,应用发生装置B,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;二氧化碳密度比空气的密度大,欲使用装置F收集CO2,则气体应从b端通入;
(4)二氧化碳和水反应生成碳酸,碳酸能使紫色石蕊变红色;M装置中下层的蜡烛显熄灭,上层的蜡烛后熄灭,所以二氧化碳具有的性质是:二氧化碳的密度比空气大,不能燃烧,不支持燃烧。

【题目】为了测定混有少量杂质的高锰酸钾固体样品中高锰酸钾的质量分数,取20g样品加热(杂质不反应),剩余固体的质量与加热时间的关系如表所示:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
剩余固体质量/g | 20 | 20 | 19.6 | 18.8 | 18.6 | 18.4 | 18.4 |
(1)t0至t1时间段,固体质量不变的原因是_________。
(2)反应中产生氧气的质量是_______。
(3)求样品中高锰酸钾的质量是多少?(写出计算过程)_______
(4)样品中高锰酸钾的质量分数是_______。
(5)该反应中转化为氧气的氧元素质量占高锰酸钾中氧元素质量的______%。