题目内容
【题目】浩瀚的大海里蕴藏着丰富的资源,开发海水资源前景广阔,探究学习小组以含有Ca2+,Mg2+,Cl﹣离子的卤水和贝壳(主要成分为CaCO3)为主要原料在实验室制备无水CaCl2,流程如图1:
请回答下列问题:
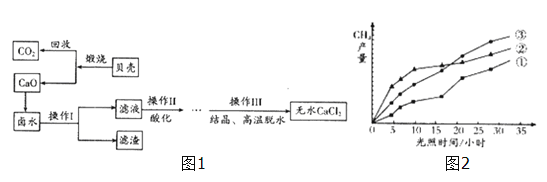
(1)操作Ⅰ中用到的玻璃仪器有烧杯、玻璃棒、 .
(2)以MgCl2为例写出卤水中除去Mg2+时发生反应的化学方程式 .
(3)操作Ⅱ酸化时应选择的酸是 (填写化学式).
(4)上述反应中未涉及的基本反应类型是 (填写字母标号)
A.复分解反应 B.置换反应
C.化合反应 D.分解反应
(5)回收的CO2在紫外线照射和催化剂作用下能与水蒸气反应,生成CH4和O2,该反应的化学方程式为 ,紫外线照射时,在不同催化剂(①、②、③)的作用下,CH4产量随光照时间的变化如图2所示,在第10小时时CH4产量最高是 (填写“①”、“②”、或“③”).
(6)已知T℃时四种化合物在水中和液氨中的溶解度如下表:
AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
H2O(1) | 170g | 92.0g | 1.50×10﹣4g | 33.3g |
NH3(1) | 86.0g | 97.2g | 0.80g | 0.00g |
上述四种物质能在液氨中发生复分解反应的化学方程式为 .
【答案】(1)漏斗.
(2)MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓;
(3)HCl;
(4)b;
(5)CO2+2H2O![]() CH4+2O2;②
CH4+2O2;②
(6)Ba(NO3)2+2AgCl═2AgNO3+BaCl2↓.
【解析】
试题分析:
(1)过滤操作中用到的玻璃仪器除了烧杯、玻璃棒还有漏斗.
(2)由反应的流程可知,氧化钙可与水反应生成氢氧化钙;氢氧化钙再与氯化镁反应将Mg2+转化为氢氧化镁沉淀而除去。反应的化学方程式是:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓;
(3)因为该过程是制取CaCl2,所以Ⅱ中的酸应选择盐酸;
(4)贝壳成分是碳酸钙,碳酸钙高温煅烧生成氧化钙和二氧化碳,属于分解反应;氧化钙和水反应生成氢氧化钙,属于化合反应;氢氧化镁能和盐酸反应生成氯化镁和水,属于复分解反应,而电解MgCl2生成金属镁和氯气,属于分解反应,所以没有涉及的基本反应类型是置换反应.
(5)CO2在紫外线照射和催化剂作用下能与水蒸气反应,生成CH4和O2,反应的化学方程式为CO2+2H2O![]() CH4+2O2;根据图示可知:在第10小时时CH4产量最高是②。
CH4+2O2;根据图示可知:在第10小时时CH4产量最高是②。
(6)由表中的数据可知,在液氨中,氯化钡是不溶性物质。所以氯化银与硝酸钡反应会生成硝酸银和氯化钡沉淀,反应的方程式是:Ba(NO3)2+2AgCl═2AgNO3+BaCl2↓.