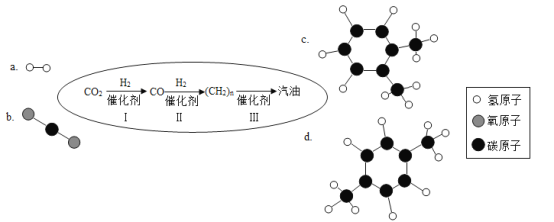
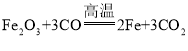题目内容
【题目】我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:
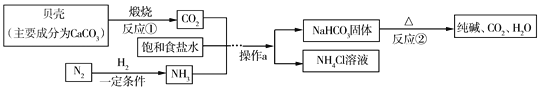
(1)反应①的基本反应类型是_____。
(2)反应②的化学方程式是_____。
(3)氨气极易溶于水,向饱和食盐水中通入氨气可得到“氨盐水”(饱和食盐水和氨水的混合物),氨盐水比食盐水更容易吸收二氧化碳,其原因是_____。
(4)下列有关侯氏制碱法说法正确的是_____。
A 反应不需要加热,可节约能源
B 生产过程中部分产物可作为原料使用
C 副产品是一种氮肥
D 碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
【答案】分解反应 2NaHCO3![]() Na2CO3+H2O+CO2↑ 氨盐水显碱性 BCD
Na2CO3+H2O+CO2↑ 氨盐水显碱性 BCD
【解析】
(1)反应①是碳酸钙高温分解反应,故填:分解反应。
(2)反应②是碳酸氢钠加热分解生成碳酸钠、水和二氧化碳,该反应的化学方程式是2NaHCO3![]() Na2CO3+H2O+CO2↑,故填:2NaHCO3
Na2CO3+H2O+CO2↑,故填:2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
(3)氨盐水比食盐水更容易吸收二氧化碳,是因为氨盐水显碱性,故填:氨盐水显碱性。
(4)下列有关侯氏制碱法说法正确的是 BCD。
A.侯氏制碱法需要加热,错误;
B.生产过程中的二氧化碳可作为原料使用,正确;
C.副产品是氯化铵,是一种氮肥,正确;
D.碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出,正确;
故填:BCD。

练习册系列答案
相关题目