题目内容
酸和碱能发生中和反应,生成盐和水.已知甲、乙分别是盐酸和氢氧化钠溶液中的一种,图中表示向甲中加入乙时溶液pH的变化曲线,请你写出图中所获取的信息.(写三条)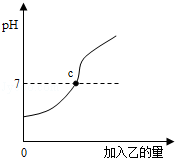
(1) ;
(2) ;
(3) .
(1)甲是盐酸;(2)乙是氢氧化钠溶液;(3)c点表示两溶液恰好中和,c点的pH为7;反应前溶液的pH小于7,随着乙溶液的加入,溶液的pH逐渐增大.(其他合理答案均可).
解析试题分析:图象中的pH值的起点小于7,说明甲溶液显酸性,为盐酸,则乙是氢氧化钠溶液;随着加入的乙的量的增加,pH值逐渐增大,与7相交的地方即c点pH值为7,二者恰好中和;
考点:中和反应及其应用.

(3分)请根据图示回答问题:
(1)当适量的液体A和气体B是下列哪种组合时,打开
弹簧夹试管中的水会重新沸腾 ;
| A.水和氧气 | B.氢氧化钠溶液和二氧化硫 |
| C.酒精和氮气 | D.氯化钙溶液和一氧化碳 |
某实验小组利用废硫酸液制备K2SO4并研究CaSO4?2H2O加热分解的产物.
(一)K2SO4的制备
(1)将CaCO3研成粉末的目的是 .
(2)上述流程中可循环使用的物质有CO2和 (填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是 .
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入 (选填序号,下同),振荡、静置,再向上层清液中滴加 ,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(二)研究CaSO4?2H2O加热分解的产物.
(5)分离所得的CaSO4?2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式 .
(6)为了测定CaSO4?2H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验.
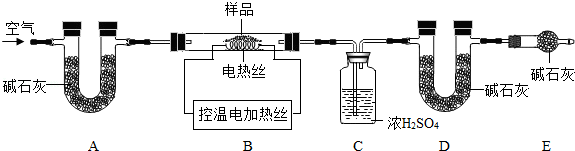
①实验前首先要 ,再装入样品.装置A的作用是 .
②已知CaSO4?2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 (填“偏大”、“偏小”或“无影响”).你认为还可选用上述的 (选填序号)两个数据组合也可求出x:y的值.
(7)CaSO4?2H2O受热会逐步失去结晶水.取纯净CaSO4?2H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示.①G点固体的化学式是 .

②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,则H~I段发生反应的化学方程式为 .
“五·一”小长假后,小刚和小敏带着快乐的心情返回学校。当他们来到实验室时,意外地发现实验桌上有一瓶敞口放置的氢氧化钠固体,由此,激发了他们的探究欲望。
【提出问题】这瓶氢氧化钠固体是否变质?
氢氧化钠露置在空气中变质的原因是 (用化学方程式表示)。
【提出猜想】猜想一:没有变质;
猜想二:部分变质;
猜想三:全部变质。
【实验探究】小刚和小强设计了如下实验方案:
小刚:取少量样品加适量蒸馏水配成溶液后,滴入几滴酚酞溶液,若观察到溶液变红色,证明该瓶氢氧化钠固体没有变质。
小敏认为小刚的结论是错误的,理由是 。
于是小敏进行了如下实验:
(1)上述实验操作④的名称 ,其中玻璃棒的作用 。
(2)步骤③中加过量氯化钙溶液的目的是 。
(3)步骤⑤中,小敏用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=10,
他判断猜想二是正确的。对他的操作方法、测量结果及结论的评价,正确的是 。
| A.方法正确,结果正确,且结论正确 |
| B.方法正确,结果正确,结论不正确 |
| C.方法不正确,结果偏大,但结论正确 |
| D.方法不正确,结果偏小,但结论正确 |
(1)在实验室里氢氧化钠需要密封保存。药品密封保存的原因很多,请你写出浓硫酸需要
密封保存的原因 。
(2)下列物质能替代小敏实验中CaCl2溶液的是 (填序号)。
①BaCl2溶液、②Ca(NO3)2溶液、③Ca(OH) 2溶液、④Ba(OH)2 溶液。


