题目内容
水、溶液在生产、生活中起着十分重要的作用,请根据所学知识回答问题。

(1)氢气是理想的清洁、高能燃料。水分解可获得H2和O2。
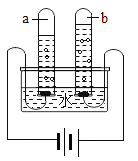
①图中,产生氢气的试管是_____(填“1”或“2”)。
②我国开发出一种新型催化剂,实现了在光照下分解水,反应的化学方程式为_____。
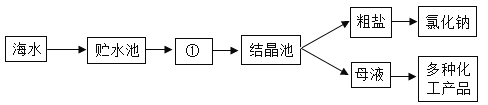
(2)粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等)。某班同学在粗盐提纯实验中,为把少量可溶性杂质Na2SO4、MgCl2一并除去,将教材中实验方案修改设计如下,请据此回答问题:

①请写出溶液A中所含的阳离子_____(用化学符号表示)。
②若试剂1是澄清石灰水,按先后顺序向溶液B加入试剂2和试剂3,则试剂2为_____。(填化学式),试剂3的作用是_____。
③请写出操作Ⅱ的名称:_____。
(3)若用所得氯化钠配制50g质量分数为6%的氯化钠溶液,需水_____mL,实验中除了用到天平、烧杯、量筒、玻璃棒等仪器外,还需用到的玻璃仪器是_____。
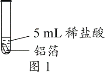
化学小组同学用图1装置探究铝与盐酸的反应。将未去除表面氧化膜的铝箔放入稀盐酸中,刚开始反应现象不明显,一段时间后反应比较剧烈,产生大量气泡,出现灰色沉淀。
(查阅资料)
①铝粉在颗粒较小时为灰黑色;铝既能与酸反应,又能与碱反应,且反应均生成氢气。
②氯化铝固体为白色颗粒或粉末,易溶于水和乙醇。
③氧化铝与盐酸反应的化学方程式为: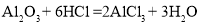 。
。
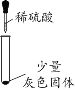
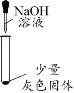
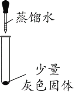
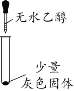
(实验一)探究灰色固体的成分
实验序号 | 1-1 | 1-2 | 1-3 | 1-4 |
实验操作 |
|
|
|
|
实验现象 | 有微量气泡产生,固体溶解 | 有少量气泡产生,固体溶解 | ____________ | 固体部分溶解 |
(实验二)探究盐酸浓度对灰色固体产生量的影响
取0.09 g铝箔和5 mL不同浓度的稀盐酸,用图1装置进行实验。
实验序号 | 盐酸浓度 | 实验现象 |
2-1 | 4.0% | 刚开始反应现象不明显,一段时间后缓慢反应,然后反应比较剧烈,有大量气泡产生,出现灰色沉淀 |
2-2 | 2.8% | 先是看不到反应现象,一段时间后缓慢反应,然后慢慢地反应比较剧烈,有大量气泡产生,出现少量灰色沉淀 |
2-3 | 2.1% | 3~4小时后明显有气泡产生,反应慢慢地比较快些,试管底部出现少量灰色沉淀 |
2-4 | 1.4% | 反应更慢,出现极少量的灰色沉淀 |
(解释与结论)
(1)铝与盐酸反应的化学方程式为___________。
(2)图1所示实验中,刚开始反应现象不明显,一段时间后才看到有气泡产生的原因是________。
(3)由实验________(填实验序号)可以判断灰色固体中含有铝。
(4)由实验1-4可知,灰色固体中还含有氯化铝。实验1-3的现象是_________。
(5)实验二的结论是__________。
(反思与交流)
(6)为了进一步探究灰色沉淀的出现是否与盐酸中的Cl-有关,可以将稀盐酸换成______进行图1所示实验。


 加热液体 B.
加热液体 B. 倾倒液体
倾倒液体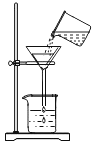 过滤 D.
过滤 D.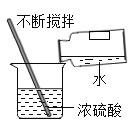 稀释浓硫酸
稀释浓硫酸