题目内容
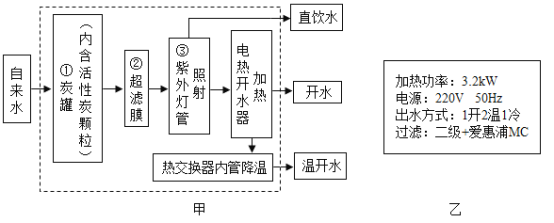
【题目】FeSO4·7H2O是一种重要的食品和饲料添加剂。某工业废渣主要成分是Fe2O3,还有少量CaCO3和SiO2(既不溶于水也不溶于稀硫酸),某兴趣小组用此废渣制备FeSO4·7H2O的实验流程如下图:
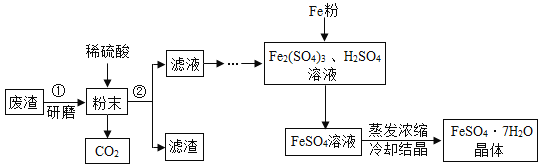
请根据流程图回答下列问题:
(1)将“废渣”研磨成“粉末”的目的是_____。
(2)操作②的名称是_____,其所需的玻璃仪器有:烧杯、玻璃棒和_____。
(3)请写出稀硫酸与Fe2O3反应的化学方程式_____。
(4)经测定“滤渣”中只有CaSO4和SiO2。请说出实验室不用块状石灰石与稀硫酸制取CO2的原因是_____。
(5)请写出Fe与Fe2(SO4)3反应生成FeSO4的化学方程式_____。
【答案】增大接触面加快反应 过滤 漏斗 ![]() 生成的CaSO4微溶于水覆盖在石灰石固体外,使反应很快停止
生成的CaSO4微溶于水覆盖在石灰石固体外,使反应很快停止 ![]()
【解析】
(1)将“废渣”研磨成“粉末”的目的是增大反应物间的接触面积,使反应更充分、更迅速;
(2)操作②的作用是将液体和难溶性固体分离,名称是过滤,其所需的玻璃仪器有:烧杯、玻璃棒和漏斗;
(3)稀硫酸与Fe2O3反应生成硫酸铁和水,化学方程式![]() ;
;
(4)经测定“滤渣”中只有CaSO4和SiO2,说明实验室不用块状石灰石与稀硫酸制取CO2的原因是生成的CaSO4微溶于水覆盖在石灰石固体外,使反应很快停止;
(5)Fe与Fe2(SO4)3反应生成FeSO4,化学方程式![]() 。
。

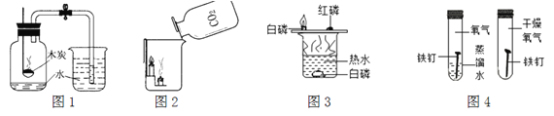
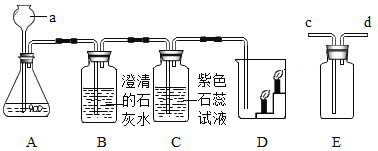
【题目】如图所示,把足量的硫粉放入氧气中充分燃烧。
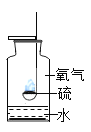
(1)硫在氧气中燃烧的化学方程式是___________________________。
(2)实验后,取少量集气瓶内的溶液于试管中,再往试管中滴加数滴的紫色石蕊溶液,振荡。发现紫色石蕊溶液变成红色。(提示:石蕊溶液是将石蕊加入水中溶解后得到的混合物)
[提出问题]是什么物质使紫色石蕊变红色呢?
[提出假设]假设1:水使紫色石蕊变红;
假设2:__________________使紫色石蕊变红;
假设3:二氧化硫与水反应的生成物使紫色石蕊变红。
[设计实验]
①我们可判断假设________________不成立,因为石蕊溶液中含有这种物质,不能使紫色变红。
②请设计一个实验方案验证另外两个假设是否成立,用文字描述实验步骤及填写预期实验现象和结论。(提供的试剂和用品有:干燥的紫色石蕊纸花若干朵、干燥的二氧化硫两瓶、水)
实验步骤 | 预期实验现象和结论 |
将干燥的紫色石蕊纸花,放入盛有______________瓶中。 | _________________,假设2不成立。 |
将干燥的紫色石蕊纸花_______________后放入盛有干燥的二氧化硫的瓶中。 | ________________________,假设______________成立。 |
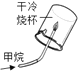
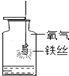
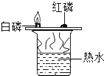
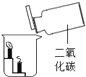
【题目】根据下图所示实验分析得出的结论中,不正确的是( )
|
|
|
|
A.甲烷燃烧生成二氧化碳和水 | B.铁能在氧气中燃烧 | C.白磷的着火点比红磷的低 | D.二氧化碳的密度比空气大,不燃烧也不支持燃烧 |
A. A B. B C. C D. D
【题目】在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表.则关于此反应的说法正确的是( )
物 质 | X | Y | Z | W |
反应前的质量(g) | 2 | 1 | 16 | 16 |
反应后的质量(g) | 12 | m | 8 | 14 |
A.物质Y一定是该反应的催化剂
B.该反应的基本类型为分解反应
C.参加反应的Z与W的质量比为4:1
D.反应后生成X的质量为12 g