题目内容
把12.5g含杂质20%的大理石放人盛有34.4g稀盐酸的烧杯中,恰好完全反应,反应后烧杯中物质的总质量比反应前减少了4.4g.求反应后所得溶液中溶质的质量分数.(大理石中的杂质不与酸反应,也不溶于水)
解:由题意可知:生成CO2的质量:4.4g;
设反应生成的氯化钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
111 44
x 4.4g
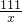 =
=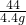 ;
;
解得:x=11.1g;
反应后所得溶液中的质量为:12.5g×(1-20%)+34.4g-4.4g=40g;
反应后所得溶液中溶质的质量分数: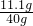 ×100%=27.75%;
×100%=27.75%;
答:反应后所得溶液中溶质的质量分数27.75%.
分析:由于反应放出气体二氧化碳,因此造成反应后物质质量减小,利用质量质量守恒定律,求出反应放出二氧化碳质量;根据反应的化学方程式,由二氧化碳气体的质量求出反应生成的氯化钙的质量;再根据质量守恒定律求得反应后溶液的质量;最后根据溶质质量分数=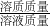 ×100%即可求得反应后所得溶液中溶质的质量分数.
×100%即可求得反应后所得溶液中溶质的质量分数.
点评:利用质量守恒定律求出反应放出二氧化碳的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.
设反应生成的氯化钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
111 44
x 4.4g
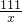 =
=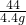 ;
;解得:x=11.1g;
反应后所得溶液中的质量为:12.5g×(1-20%)+34.4g-4.4g=40g;
反应后所得溶液中溶质的质量分数:
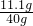 ×100%=27.75%;
×100%=27.75%;答:反应后所得溶液中溶质的质量分数27.75%.
分析:由于反应放出气体二氧化碳,因此造成反应后物质质量减小,利用质量质量守恒定律,求出反应放出二氧化碳质量;根据反应的化学方程式,由二氧化碳气体的质量求出反应生成的氯化钙的质量;再根据质量守恒定律求得反应后溶液的质量;最后根据溶质质量分数=
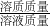 ×100%即可求得反应后所得溶液中溶质的质量分数.
×100%即可求得反应后所得溶液中溶质的质量分数.点评:利用质量守恒定律求出反应放出二氧化碳的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
同学们把测定某地石灰石中碳酸钙的含量作为研究性学习的内容。
晓光同学的做法是:将10.2g石灰石放入一烧杯中,不断向其中滴加20%的稀盐酸直到不再冒气泡为止,共用去该盐酸36.5g。晓光假定石灰石中除碳酸钙以外的杂质都不与盐酸反应。他根据上述实验数据对该石灰石中碳酸钙含量的计算是:
解:
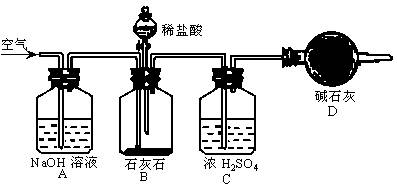
朱琳同学的做法与晓刚不同。她采用如下图所示的实验装置进行测定。她称取10g石灰石置入C装置中,在反应开始前,缓缓鼓入空气数分钟,使装置内的空气不再含二氧化碳,称出装置D的质量M1;然后缓缓加入稀盐酸至恰好不再产生气体为止。继续鼓入空气数分钟,目的是使B、C装置内的二氧化碳气体全部被装置D内的碱石灰吸收,再次称出装置D的质量M2;朱琳先算出生成的二氧化碳的质量(M2—M1),随之求出石灰石中碳酸钙的含量是97%。
|
成分 |
CaCO3 |
SiO2 |
Fe2O3 |
Al2O3 |
MgO |
|
含量% |
96.51 |
2.12 |
0.24 |
0.71 |
0.42 |
已知该石灰石的精确测定值如下表所示:
排除二位同学在称量、观测方面的误差,请你从实验的原理和方法角度进行分析:
晓光实验结果的误差原因是:_______________________________;
朱琳实验结果的误差原因是:_______________________________;