题目内容
同学们把测定某地石灰石中碳酸钙的含量作为研究性学习的内容。晓光同学的做法是:将10.2g石灰石放入一烧杯中,不断向其中滴加20%的稀盐酸直到不再冒气泡为止,共用去该盐酸36.5g。晓光假定石灰石中除碳酸钙以外的杂质都不与盐酸反应。他根据上述实验数据对该石灰石中碳酸钙含量的计算是:
解:
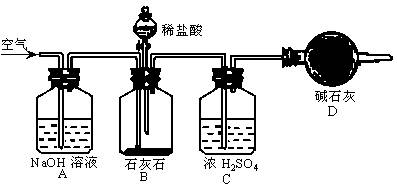
朱琳同学的做法与晓刚不同。她采用如下图所示的实验装置进行测定。她称取10g石灰石置入C装置中,在反应开始前,缓缓鼓入空气数分钟,使装置内的空气不再含二氧化碳,称出装置D的质量M1;然后缓缓加入稀盐酸至恰好不再产生气体为止。继续鼓入空气数分钟,目的是使B、C装置内的二氧化碳气体全部被装置D内的碱石灰吸收,再次称出装置D的质量M2;朱琳先算出生成的二氧化碳的质量(M2—M1),随之求出石灰石中碳酸钙的含量是97%。
|
成分 |
CaCO3 |
SiO2 |
Fe2O3 |
Al2O3 |
MgO |
|
含量% |
96.51 |
2.12 |
0.24 |
0.71 |
0.42 |
已知该石灰石的精确测定值如下表所示:
排除二位同学在称量、观测方面的误差,请你从实验的原理和方法角度进行分析:
晓光实验结果的误差原因是:_______________________________;
朱琳实验结果的误差原因是:_______________________________;
答案:
解析:
提示:
解析:
| 解:设:碳酸钙的质量为x
CaCO3+2HCl══CaCl2+CO2十+H2O 100 73 X 36.5g´20% 100∶X=73∶7.3g X=10g 石灰石中碳酸钙的含量为:(10g/10.2g)´100%=98% 晓光同学的实验没有考虑到石灰石中除碳酸钙以外的所谓“杂质”也是可以与盐酸反应的,以及盐酸的挥发。因此,根据消耗盐酸的质量所计算的碳酸钙质量分数偏大。 朱琳同学忽略了盐酸挥发的氯化氢气体也会被装置D吸收,用M2-M1的质量求得的碳酸钙质量分数也会偏大。
|
提示:

练习册系列答案
相关题目