题目内容
【题目】等质量的甲、乙、丙三种金属,分别放入与足量的稀硫酸反应(反应后甲、乙、丙三种金属均显+2价),生成H2的质量与反应时间的关系如图所示,下列说法不正确的是( )
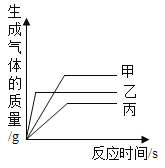
A. 生成氢气的质量:甲![]() 乙
乙![]() 丙B. 消耗硫酸的质量:甲
丙B. 消耗硫酸的质量:甲![]() 乙
乙![]() 丙
丙
C. 三种金属的活泼性:乙![]() 甲
甲![]() 丙D. 相对原子质量:乙
丙D. 相对原子质量:乙![]() 丙
丙![]() 甲
甲
【答案】D
【解析】
A、由纵坐标,生成氢气的质量:甲![]() 乙
乙![]() 丙,故A正确;
丙,故A正确;
B、由质量守恒定律,反应前后氢元素的质量不变,生成氢气的质量:甲![]() 乙
乙![]() 丙,则消耗硫酸的质量:甲
丙,则消耗硫酸的质量:甲![]() 乙
乙![]() 丙,故B正确;
丙,故B正确;
C、金属的活动性越强,反应速率越快,根据至完全反应所消耗的时间,三种金属的活泼性:乙![]() 甲
甲![]() 丙,故C正确;
丙,故C正确;
D、等质量的金属和足量的稀硫酸完全反应产生氢气的质量=金属的化合价/金属的相对原子质量×参加反应的金属质量,反应后甲、乙、丙三种金属均显+2价,生成氢气的质量:甲>乙>丙,则相对原子质量:丙>乙>甲,故D不正确。故选D。

练习册系列答案
相关题目