��Ŀ����
����Ŀ��ˮ����һ�㺬 CaCO3��Mg��OH��2�����ܺ��� MgCO3�������������κ����ʣ���ijͬѧȡ�����ᾧˮ��ˮ����Ʒ�����о���������ͼ��������˵����ȷ���ǣ����������Է���������CaCO3 100 Mg��OH��2 58 MgCO3 84����������
A. ��ˮ���������� CO2���� 2.64 g
B. ��ˮ����һ������ CaCO3��Mg��OH��2��һ������ MgCO3
C. ��ˮ����һ������ CaCO3��Mg��OH��2�����ܺ��� MgCO3
D. ��ˮ����һ������ CaCO3��Mg��OH��2�� MgCO3
���𰸡�AD
��������
���������غ㶨�ɡ����ɶ�����̼��������ˮ���������û�ѧ����ʽ���з���������ʱ�ɲ��ü���ķ������м���Աȵó����ۡ�
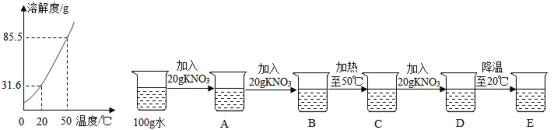
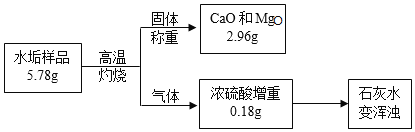
A���������غ㶨�ɿ�֪����ˮ����������CO2���������Ϊ��5.78g��2.96g��0.18g��2.64g��
����B��C��D�������ˮ���в���̼��þ����̼����ڸ��µ������·ֽ�Ϊ�����ƺͶ�����̼��������þ�ڸ��µ������·ֽ�Ϊ����þ��ˮ������ˮ�������������������þ���������ٽ�һ������������Ƶ����������������Ƶ����������û�ѧ����ʽ�����̼��Ƶ����������ݶ�����̼���������û�ѧ����ʽ�����̼��Ƶ��������Ƚϼ������Ƿ���ȣ�����ͬ����̼��þ��������ȣ���һ������̼��þ��
Ũ�������ص�������Ϊ������þ�ֽ�����ˮ��������������0.18gˮ��ͬʱ��������þ������Ϊx����
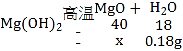
![]()
x��0.4g
�������Ƶ�����Ϊ��2.96g��0.4g��2.56g��
������2.56g��������Ҫ̼��Ƶ�����Ϊy����

![]()
y��4.57g
������2.56g��������Ҫ̼��Ƶ�����Ϊ4.57g
������2.64g������̼��Ҫ̼��Ƶ�����Ϊz����

![]()
z��6g
��Ϊ4.57g��6g�����Ը�ˮ����һ������ CaCO3��Mg��OH��2 �� MgCO3��
��ѡ��AD��

����Ŀ��K2CO3��KNO3�ڲ�ͬ�¶�ʱ���ܽ�ȼ����ܽ���������¡�����˵��������ǣ� ��
�¶�/�� | 20 | 30 | 50 | 60 | 80 | |
�ܽ��/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
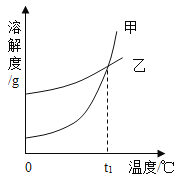
A.t����60����80��֮��
B.t��ʱ��������Һ����������������һ�����
C.��60��ʱ��210g KNO3����Һ������20��������������88.4g
D.���ֱ���Һ��80�����µ�20������������������������ᾧˮ�����Ƚ�
����Ŀ����������ͭ�dz��������ֽ�����ͬѧ�Ƿ��������е�����ͭ��Ʒ����һ�㲻�÷��⣬������Ʒһ����Ҫ���������
��������⣩���Dz�����Ϊ��������ͭ���ֽ��������Ļ����ǿ�أ�
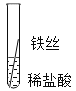
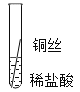
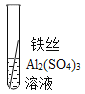
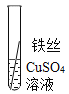
��ʵ��̽����ͬѧ�Ƕ����ֽ����Ļ��˳��չ����̽�����������̽������д�ո���ϸ��ͬ����˿����˿��ͭ˿�ֱ���������ͬ������������Ҳ��ͬ��ϡ�����У�
���� |
|
|
| ��������ó��������˳�� |
Ƭ�̺����� | ���������� | ������ | ������ |
|
�����Ӻ����� | ���������� | �д������� | ������ | _________________ |
�����۽�����Ϊʲôͬһ��ʵ��ó������ֽ����أ�ͬѧ�Ǵ���������ʲ�����������ϣ���������˿��ϡ�����ж�ʱ���������ݣ�����Ϊ���������ܵ�����Ĥ������ϡ���ᷴӦ��
����˼���ۣ�����������ʵ��ʱ�轫�������д�ĥ����ĥ��Ŀ����_________________��
��ʵ����֤��Ϊ�˽�һ��ȷ����������ͭ�����ֽ����Ļ��˳��ͬѧ���ֽ�������ϸ��ͬ�ġ���ĥ������˿�ֱ������������Һ������ͭ��Һ�У�
���� |
|
| ��������ó����ֽ������˳�� |
���� | ���������� | ___________________ |
|
д����������ͭ��Һ��Ӧ�Ļ�ѧ����ʽ___________________________��
����չǨ�ƣ�
��1����ֻ��һ֧ʢ������ϡ������Թܣ�ֻ��������Ž���˿�IJ���˳������ϡ���ᷴӦ��Ҫһ�ν�ϡ���������꣩��Ҳ��֤����������ͭ�����ֽ����Ļ��˳����˿�IJ���˳��Ϊ_________��
��2��������������ģ�������õĴ�������Ҳ��������˳���йأ���д����������ͭ���ֽ������ϱ��������õ��Ⱥ�˳��___________________________��