题目内容
【题目】根据下图所示的溶解度曲线(
A. B都为固态物质),判断下列说法中正确的是( )
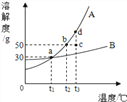
A.t1℃时,A和B饱和溶液的质量分数都为30%
B. t3℃时,A的溶解度比B大,故A溶液的质量分数也一定比B溶液大
C. B的浓溶液的质量分数一定比A的稀溶液大
D. 把c点对应A的溶液降温至t2℃可得A的饱和溶液,继续降温可析出A晶体
【答案】D
【解析】A、由于在t1℃时,A的溶解度是30g,则其饱和溶液中溶质的质量分数为:![]() ×100%=23.1%,故A错误;
×100%=23.1%,故A错误;
B、根据图象可以看出t3℃时,A的溶解度比B大,只能说明t3℃时A饱和溶液的质量分数比B饱和溶液的质量分数大,若不是饱和溶液则无法比较出溶液质量分数的大小,故B错误;
C、由于没有说明温度,因此无法比较B的浓溶液和A的稀溶液中溶质的质量分数的大小,故C错误;
D、根据图象不难看出,c点对应的A的溶液是t3℃时的不饱和溶液,降温至t2℃时,溶液恰好达到饱和,由于A的溶解度随温度的降低而减小,若再降温溶液中就会有晶体析出,故D正确;
故选D.

 名校课堂系列答案
名校课堂系列答案【题目】盐城的城市建设可谓是日新月异,在城市建设、生产、生活中材料有着广泛的应用。
(1)下列生活用品,主要利用金属具有良好导热性的是________(填序号),一般铜导线外面包有聚乙烯绝缘层,聚乙烯属于________材料。

(2)铁制品在空气中会发生锈蚀,其原因是铁与空气中的___________共同作用的结果。为防止钢铁制品的锈蚀,厨房中的铁锅和菜刀通常需做的防护是_____________(要求一种方法即可)。
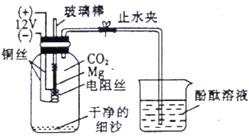
(3)化学小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:
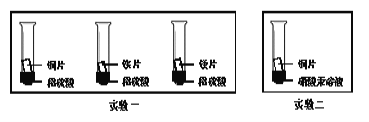
根据实验一判断出镁的金属活动性比铁强,依据的现象是___________;根据实验二的现象应得出的结论是__________。
(4)苗苗同学向含有FeSO4和CuSO4两种溶质的溶液中,加入一定质量镁粉,充分反应后过滤,滤液呈浅绿色,再向滤液中放入一枚洁净的铁钉,足够时间后取出,铁钉表面无变化。根据此现象作出了下列判断,你认为正确的是_____________(填序号)。
A. 滤纸上一定有Fe,可能有Mg、Cu
B. 滤纸上一定有Cu,可能有Fe,一定没有Mg
C. 滤液中一定有FeSO4,可能有MgSO4 、CuSO4
D. 滤液中一定有MgSO4、FeSO4,一定没有CuSO4
(5)为分析某由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该混合物各20g,分别缓慢加入到50g、100g、150g某稀硫酸中,测得三组实验数据如表:
第I组 | 第Ⅱ组 | 第Ⅲ组 | |
稀硫酸的质量/g | 50 | 100 | 150 |
溶解固体的质量/g | 10.0 | 16.0 | 16.0 |
根据实验及有关数据进行分析与计算:
①第I组实验中反应物___________(填“氧化铜“、“稀硫酸”或“氧化铜与稀硫酸”)反应完。
②20g样品中含氧化铜的质量分数分别为____________。
③计算所用的稀硫酸溶质的质量分数为____________(写出计算过程)
④将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,画出在该混合溶液中加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图。
 ___________________
___________________