题目内容
【题目】质量守恒定律的定量研究对化学科学的发展具有重大作用。
(1)我国从2011年5月1日起,实行酒驾入刑。“酒精检测仪”可榆查司机是否酒后驾车,其反应原理为C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9X,反应中红色的CrO3转变为绿色的Cr2(SO4)3,其中X的化学式为_______。
(2)图为某化学反应的微观模拟图,“O”和 “●”分别表示两种不同元素的原子。
![]()
由“O●”聚集成的物质_______(填“可能”或“不可能”)是氧化物,参加反应的两种反应物的分子个数比为_______,此反应的基本反应类型为_______。
(3)已知m1g镁条在空气中完全燃烧,生成m2g氧化镁(不考虑其他反应),m1_______m2。小西在做该实验时,观察到耀眼的白光,冒出大量白烟,称量无误时,发现m1>m2。原因是_____________________。
【答案】 H2O 可能 2:1(或1:2) 化合反应 <(或小于) 生成物氧化镁部分以白烟的形式扩散到空气中
【解析】分析:(1)根据质量守恒定律,反应前后原子种类和个数都不变,分别统计出反应前后原子种类及个数,比较分析就可以求出所的物质的化学式;
(2)观察微观模拟图,总结构成物质的基本微粒,找出化学反应中各物质的粒子个数关系,通过构成物质的基本微粒判定物质的反应类型;
(3)根据质量守恒定律和实验现象分析.
解答:解:(1)根据质量守恒定律,反应前后原子种类和个数都不变,由方程式知反应物中含有的原子种类及原子个数为C,2;H,18;Cr,4;O,37;S,6;已知生成物中含有的原子种类及原子个数为C,2;Cr,4;O,28;S,6;比较分析可知X中含有H和O元素,其原子个数分别为2和1,故X的化学式为H2O;
(2)将图中前后无变化的微粒去除得图: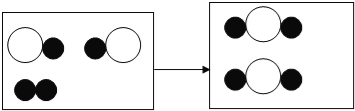
图示表示 由“![]() ”聚集成的物质由两种元素组成,可能一种为氧元素,所以该物质可能为氧化物;
”聚集成的物质由两种元素组成,可能一种为氧元素,所以该物质可能为氧化物;
每1个反应物分子和2个另一种反应物分子反应,两种反应物分子个数比为1:2(或2:1);该反应的反应物是两种,生成物是一种,属于化合反应.
(3)根据质量守恒定律,生成氧化镁的质量=参加反应的镁的质量+氧气的质量,所以m1小于m2;镁带燃烧时放出耀眼的白光,放出大量的热,放出大量的白烟,仔细观察会发现:白烟有很大一部分向上,生成物氧化镁部分以白烟的形式逸散(或扩散)到空气中.
故答案为:(1)H2O;
(2)可能,1:2(或2:1);化合反应;
(3)小于,生成物氧化镁部分以白烟的形式逸散(或扩散)到空气中.

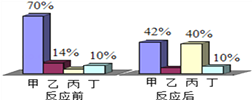
【题目】一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质的质量如下表后,下列说法错误是( )
甲 | 乙 | 丙 | 丁 | |
反应前/g | 5 | 2 | 20 | 22 |
反应后/g | 待测 | 11 | 28 | 5 |
A.该反应为分解反应
B.甲一定是该反应的催化剂
C.该反应中参加该反应的乙丙物质的质量比为11:28
D.丁一定属于化合物