题目内容
【题目】某厂生产的纯碱中含有少量氯化钠.取12g该样品于烧杯中,并滴加稀盐酸至73g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6g.请计算:
(1)产生二氧化碳气体的质量是_____________________ g?
(2)样品中碳酸钠的质量?_____________________
(3)反应后所得溶液中溶质的质量分数?(结果保留到 1%)_____________________
【答案】4.4 10.6g 16%
【解析】
(1)烧杯中的物质前后减少的质量为二氧化碳的质量;
(2)根据二氧化碳的质量可求出碳酸钠的质量,进而可求出纯碱样品中碳酸钠的质量分数;
(3)依据反应方程式可求生成的氯化钠质量,同时可依据碳酸钠的质量求出原混合物中氯化钠的质量,进而依据反应后溶液的质量求出所得溶液的溶质质量分数。
(1)二氧化碳的质量=12g+73g-80.6g=4.4g
(2)设样品中Na2CO3的质量为x,生成NaCl的质量为y
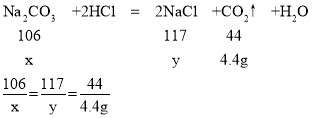
x=10.6g y=11.7g
答:该纯碱样品中碳酸钠的质量是10.6g。
(3)纯碱样品中NaCl的质量=12g-10.6g=1.4g
∴溶液中NaCl的总质量=11.7g+1.4g=13.1g
反应所得溶液中溶质质量分数=![]() ×100%≈16%
×100%≈16%
答:反应后所得溶液中溶质的质量分数是16%。
故答案为:(1)4.4;(2)10.6g;(3)16%。

 华东师大版一课一练系列答案
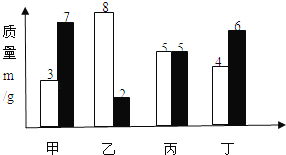
华东师大版一课一练系列答案【题目】在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如表所示。根据表中信息判断下列说法正确的是
物 质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量 | 2 | 30 | 20 | 10 |
反应后的质量 | m | 39 | 5 | 16 |
A.该反应是化合反应B.甲一定是该反应的催化剂
C.反应过程中乙、丙变化的质量比为3:5D.丙可能是单质
【题目】20℃时,在盛有 100g 水的烧杯中加入 70g 硝酸钾,充分溶解后,逐渐升温(不 考虑水蒸发的影响),测定不同温度时剩余固体质量。测定结果记录如下表:
溶液温度/℃ | 20 | 30 | 40 | 50 | 60 |
剩余固体质量/g | 38.4 | 24.2 | 6.1 | 0 | 0 |
(1)20℃时,硝酸钾的溶解度为_____。
(2)30℃时,所得溶液是硝酸钾的_____(填“饱和”或“不饱和”)溶液,该溶液中硝酸钾 的质量分数为_____(结果保留到 0.1%)
(3)温度从 50℃升高到 60℃过程中,溶液中硝酸钾的质量分数_____(填字母)。
A 变大 B 变小 C 不变 D 无法判断
(4)将 60℃时接近饱和的硝酸钾溶液变成饱和溶液,下列方法能达到目的有_____(填字母)。
a 升温 b 降温 c 加适量硝酸钾 d 加适量水 e 恒温蒸发水
(5)某同学要配制 50g 溶质质量分数为 15%的硝酸钾溶液,实验时发现硝酸钾已结块,为 了较快地溶解,合理的方法有_____(填字母)。
A将硝酸钾研碎 B 用热水溶解 C 多加一些水 D 用玻璃棒搅拌
【题目】某密闭容器中有X、氧气、二氧化碳三种物质,在一定条件下充分反应,反应前后各物质质量的数据记录如下:
物质 | X | O2 | CO2 | H2O |
反应前的质量/g | 46 | 128 | 1 | 0 |
反应后的质量/g | 0 | 待测 | 89 | 54 |
在下列判断中,正确的是( )
A. 物质X由碳、氢元素组成 B. 物质X由碳、氢、氧元素组成
C. 充分反应后剩余氧气质量为16克 D. 生成CO2与H2O的质量比是89:54
【题目】材料在交通工具上有着广泛的应用,根据下列信息回答问题。
应用 |
| 大飞机 C919 |
共享汽车 |
用到的材料 | 轮胎:橡胶 | 机翼:铝锂合金 | 车身:钢 |
(1)上述交通工具用到的材料属于金属材料的是__________ (填一种即可),属于有机合成材料的是__________。
(2)汽车车身表面的烤漆不仅美观,还能起到防锈的作用,工业上常用稀盐酸来除铁锈(Fe2O3),该反应的化学方程式是______________。
(3)化石燃料的大量使用,带来了环境的污染和资源的枯竭等问题,共享汽车在广泛推广使用乙醇汽油,其好处是___________。