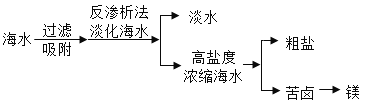
题目内容
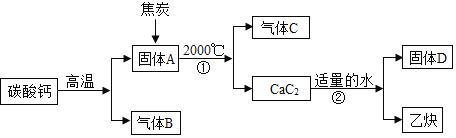
【题目】工业上生产电石![]() 并制备重要工业原料乙炔
并制备重要工业原料乙炔![]() 流程如下:
流程如下:
资料:![]() .碳酸钙高温分解可得两种氧化物。
.碳酸钙高温分解可得两种氧化物。
![]() .乙炔的相对分子质量是26,一个乙炔分子有四个原子构成。
.乙炔的相对分子质量是26,一个乙炔分子有四个原子构成。
![]() .B、C组成的元素相同,C有毒。
.B、C组成的元素相同,C有毒。
(1)写出A、B、C的化学式:A______B______C______。
(2)反应①化学方程式为______。
(3)将一定量的乙炔![]() 完全燃烧,生成
完全燃烧,生成![]() 水和
水和![]() 二氧化碳,则乙炔的化学式为______。
二氧化碳,则乙炔的化学式为______。
(4)若向D的澄清溶液中通入二氧化碳,有白色浑浊现象,则反应②的化学方程式为______。
【答案】CaO CO2 CO CaO+3C![]() CO↑+CaC2 C2H2 Ca(OH)2+CO2=CaCO3↓+H2O
CO↑+CaC2 C2H2 Ca(OH)2+CO2=CaCO3↓+H2O
【解析】
碳酸钙高温分解为固体氧化钙和气体二氧化碳,B是CO2,B、C组成的元素相同,C有毒,所以C为CO,根据化学反应前后元素的种类不变,碳化钙和水反应生成乙炔和氢氧化钙。
(1)化学式:A是 CaO,B是 CO2,C 是CO。
(2)根据题给信息,反应①的化学方程式为:CaO+3C![]() CO↑+CaC2。
CO↑+CaC2。
(3)将定量的乙炔(CxHy)完全燃烧,生成1.8g水和8.8g二氧化碳,则碳原子和氢原子的个数比为(![]() ×2):
×2):![]() =1:1,由于乙炔的相对分子质量是26,所以乙炔的化学式为 C2H2。
=1:1,由于乙炔的相对分子质量是26,所以乙炔的化学式为 C2H2。
(4)若向D的澄清溶液中通入二氧化碳,有白色浑浊现象,则是氢氧化钙和二氧化碳反应生成碳酸钙和水,对应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目