题目内容
【题目】A、B、C、D四种物质之间的一步转化关系如图所示(部分反应物、生成物及反应条件围标出),它们均含有同种金属元素.A是大理石的主要成分,B是氧化物,C为碱、D由两种元素组成.下列判断错误的是( ) 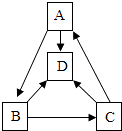
A.A的化学式为CaCO3
B.D物质不属于盐
C.表中未涉及的基本反应类型是置换反应
D.B→C的化学方程式为CaO+H2O═Ca(OH)2
【答案】B
【解析】解:根据“A是大理石的主要成分”,则推测A为碳酸钙;根据“B是氧化物,C为碱、D由两种元素组成”,结合图框,则推测B是氧化钙,C为氢氧化钙、D可能为氯化钙;代入检验,符合题意. A、根据分析,A的化学式为CaCO3 , 故正确;
B、根据分析,D可能为氯化钙,故可能为盐,故错误;
C、A→B,碳酸钙高温分解生成氧化钙和二氧化碳,为分解反应;A→D,碳酸钙与稀盐酸反应,为复分解反应;B→D,氧化钙与稀盐酸反应,为复分解反应;B→C,为氧化钙与水反应,为化合反应;C→D,氢氧化钙与稀盐酸反应,为复分解反应;C→A为二氧化碳与氢氧化钙反应,不是基本反应,则表中未涉及的基本反应类型是置换反应,故正确;
D、B→C的化学方程式为CaO+H2O═Ca(OH)2 , 故正确.
故选B.
根据“A是大理石的主要成分”,则推测A为碳酸钙;根据“B是氧化物,C为碱、D由两种元素组成”,结合图框,则推测B是氧化钙,C为氢氧化钙、D为水或氯化钙;代入检验.

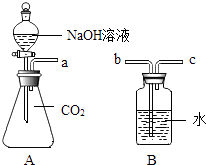
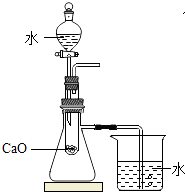
【题目】某兴趣小组同学欲探究NaOH溶液与CO2气体的反应,设计如图所示实验装置:
(1)若导管a与b连接,将分液漏斗中的NaOH溶液注入锥形瓶,关闭分液漏斗上的活塞,振荡,然后打开导管上的活塞,观察到的实验现象是 , CO2与NaOH反应的化学方程式是;
(2)探究反应后锥形瓶内溶液中溶质的成分: 已知Na2CO3+H2O+CO2═2NaHCO3
NaHCO3+NaOH═Na2CO3+H2O
【提出猜想】Ⅰ.NaOH和Na2CO3;Ⅱ.;
Ⅲ.NaHCO3;Ⅳ.Na2CO3和NaHCO3 .
(3)【查阅资料】①Ca(OH)2与Na2CO3、NaHCO3均能反应且有白色沉淀生成; ②CaCl2与Na2CO3能反应且有白色沉淀生成,与NaHCO3不反应;
③NaHCO3溶液显碱性,可与酸反应生成CO2气体.
【设计实验】限选试剂:Ca(OH)2溶液、CaCl2溶液、稀盐酸、酚酞试液.
实验操作 | 实验现象 | 实验结论 |
1.取少量反应后溶液于试管中,加入足量的 | 产生白色沉淀 | 猜想Ⅲ不成立 |
2.将操作Ⅰ所得混合物过滤,向滤液中加入足量的 | 猜想Ⅳ成立 |
【拓展应用】联想到空气中有CO2 , 所以实验室中的氢氧化钠溶液应保存.