题目内容
今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验:
①第一份加足量NaOH溶液,加热,收集到气体0.68g;
②第二份加足量BaCl2溶液后,得干燥沉淀6.57g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
①第一份加足量NaOH溶液,加热,收集到气体0.68g;
②第二份加足量BaCl2溶液后,得干燥沉淀6.57g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
分析:根据题目给出的信息:第一份加足量NaOH溶液,加热,收集到气体0.68g,那么本气体是氨气,一定有NH4+离子;第二份加足量BaCl2溶液后,得干燥沉淀6.57g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g,因此一定有CO32-、SO42-;因为Ba2+与CO32-、SO42不能共存,因此一定没有Ba2+;通过摩尔数计算阴离子总数大于阳离子总数(0,04摩尔),所以一定含钠离子,Cl-可能有,也可能没有.
解答:解:A、Na+对①②的现象,没有影响,通过摩尔数计算阴离子总数大于阳离子总数(0,04摩尔),所以一定含钠离子,故选项错误;
B、第二份加足量BaCl2溶液后,得干燥沉淀6.57g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g,减少的沉淀是碳酸钡,剩余的沉淀是硫酸钡,因此一定有CO32-、SO42-,故选项错误;
C、因为Ba2+与CO32-、SO42不能共存,因此一定没有Ba2+;加足量NaOH溶液,加热,收集到气体0.68g,那么本气体是氨气,因此一定有NH4+离子,故选项错误;
D、Cl-对①②的现象,没有影响,因此可能有,也可能没有,故选项正确;
故选D.
B、第二份加足量BaCl2溶液后,得干燥沉淀6.57g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g,减少的沉淀是碳酸钡,剩余的沉淀是硫酸钡,因此一定有CO32-、SO42-,故选项错误;
C、因为Ba2+与CO32-、SO42不能共存,因此一定没有Ba2+;加足量NaOH溶液,加热,收集到气体0.68g,那么本气体是氨气,因此一定有NH4+离子,故选项错误;
D、Cl-对①②的现象,没有影响,因此可能有,也可能没有,故选项正确;
故选D.
点评:本考点考查的是物质的鉴别,要根据题目给出的信息,由现象得出正确的结论.鉴别题是初中阶段的一个重点,可以根据不同的性质来鉴别,因此掌握好常见物质和酸碱盐的性质,问题就会迎刃而解.本考点主要出现在选择题和填空题中.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
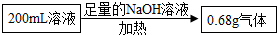 由此计算:200mL溶液中含NH4+的质量为
由此计算:200mL溶液中含NH4+的质量为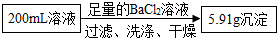 由此计算:200mL溶液中含CO32-的质量为
由此计算:200mL溶液中含CO32-的质量为