题目内容
(2007?资阳)元素周期表是科学家根据各元素的原子结构规律编排的,每一种元素都在不同的横排(周期)和纵行(族)所对应的位置上,周期数代表了该元素原子核外的电子层数,主族(ⅠA族-ⅦA族)数代表了该元素原子最外电子层上的电子数.某元素R在周期表中的位置为:4周期、ⅠA族,则下列关于R元素及其原子的叙述正确的是( )
分析:A、根据题干信息以及核外电子的排布规律分析解答;
B、依据R原子核外的电子层与氧原子核外电子层的情况分析解答;
C、依据该原子失去电子后的情况分析解答即可;
D、依据该元素的原子最外层电子数的情况分析解答;
B、依据R原子核外的电子层与氧原子核外电子层的情况分析解答;
C、依据该原子失去电子后的情况分析解答即可;
D、依据该元素的原子最外层电子数的情况分析解答;
解答:解:A、由题干信息可知R原子的电子层数是4,最外层电子数是1,所以其核外电子的排布情况为2、8、8、1,由于原子中质子数等于核外电子数,所以R原子核内有19个质子;
B、氧元素的核外电子数是8,共分两层排布,而R元素的核外电子分四层排布;
C、R原子失去1个电子形成阳离子,电子层数少了一层,应该是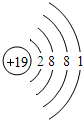 ;
;
D、R原子最外层电子数是1化学反应中易失掉1个电子形成带一个单位正电荷的阳离子,所以R在化合物中的化合价通常为+1价;
故选A
B、氧元素的核外电子数是8,共分两层排布,而R元素的核外电子分四层排布;
C、R原子失去1个电子形成阳离子,电子层数少了一层,应该是
 ;
;D、R原子最外层电子数是1化学反应中易失掉1个电子形成带一个单位正电荷的阳离子,所以R在化合物中的化合价通常为+1价;
故选A
点评:此题是对元素周期表规律的考查,掌握周期数与电子层数以及最外层电子数与族的关系是解题的关键;

练习册系列答案
相关题目