题目内容
【题目】将一定量的苯(C6H6)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和一种未知物X;测得反应前后物质的质量如下表:
物质 | 苯 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 3.9 | 9.6 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 6.6 | 2.7 | m |
下列判断正确的是( )
A.表中m的值为13.5
B.该反应属于分解反应
C.物质X能在氧气中燃烧
D.物质X中一定含有氢元素
【答案】C
【解析】解:由表格信息可知反应后CO2质量增加了6.6g,是生成物;H2O质量增加了2.7g,是生成物;O2质量减少了9.6g,是反应物;苯的质量减少了3.9g克,是反应物;生成物还少4.2g,所以X是生成物.
A、反应后生成的物质x的质量4.2g,故m的值为4.2g,故选项错误.
B、反应物是苯和O2 , 生成物是CO2、H2O和X,不是分解反应,故选项错误.
C、根据反应前后元素质量相等,苯中含碳元素的质量为 ![]() ,二氧化碳中含有碳元素的质量为
,二氧化碳中含有碳元素的质量为 ![]() =1.8g,物质X含有碳元素的质量为3.6g﹣1.8g=1.8g.苯中含氢元素的质量为3.9g×
=1.8g,物质X含有碳元素的质量为3.6g﹣1.8g=1.8g.苯中含氢元素的质量为3.9g× ![]() =0.3g,2.7g水中含氢元素的质量为2.7g×
=0.3g,2.7g水中含氢元素的质量为2.7g× ![]() =0.3g,反应前后氢元素的质量相等,故物质X不含有氢元素.则X中含氧元素的质量为:4.2g﹣1.8g=2.4g;X中含有C、O两种元素,两种元素的质量比为1.8g:2.4g=3:4,该物质为CO,具有可燃性,能在氧气中燃烧.故选项正确.
=0.3g,反应前后氢元素的质量相等,故物质X不含有氢元素.则X中含氧元素的质量为:4.2g﹣1.8g=2.4g;X中含有C、O两种元素,两种元素的质量比为1.8g:2.4g=3:4,该物质为CO,具有可燃性,能在氧气中燃烧.故选项正确.
D、由C中计算过程可知:X中含有C、O两种元素,故选项错误.
故选C.
根据质量守恒定律可知:反应后质量减少的物质是反应物,质量增加的物质是生成物;根据质量守恒定律可以确定X的质量;通过计算苯、氧气、二氧化碳、水中各元素的质量,推算出X中所含元素的种类.

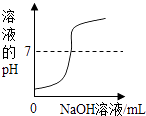
【题目】下列图象不能正确反映其对应操作的是( )
A | B | C | D |
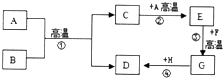
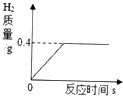
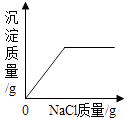
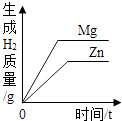
|
|
|
|
在一定量的AgNO3溶液中逐滴加入NaCl溶液 | 等物质的量的Zn和Mg分别与等体积等质量分数的稀硫酸(足量)反应 | 向稀盐酸溶液中逐滴加入氢氧化钠溶液 | 等质量CaCO3分别与等体积等质量分数的稀盐酸(足量)反应 |
A.A
B.B
C.C
D.D