题目内容
【题目】将一定质量的金属锌投入到100g稀硫酸中恰好完全反应,放出气体的质量与反应时间的关系如图所示,试求: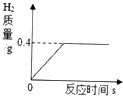
(1)完全反应后生成H2的质量为g;
(2)所用硫酸溶液中溶质的质量分数?(结构精确到0.1%)
(3)所得溶液中溶质的质量分数?(结构精确到0.1%)
【答案】
(1)0.4
(2)
解:设锌质量为x,硫酸质量为y,生成硫酸锌质量为z,
Zn+H2SO4═ZnSO4+H2↑,
65 98 161 2
x y z 0.4g
![]() =
= ![]() =
= ![]() =
= ![]() ,
,
x=13g,y=19.6g,z=32.2g,
所用硫酸溶液中溶质的质量分数为: ![]() ×100%=19.6%,
×100%=19.6%,
答:所用硫酸溶液中溶质的质量分数为19.6%
(3)
解:所得溶液中溶质的质量分数为: ![]() ×100%=28.6%,
×100%=28.6%,
答:所得溶液中溶质的质量分数是28.6%
【解析】解:(1)由图中信息可知,完全反应后生成H2的质量为0.4g.
故填:0.4
锌和稀硫酸反应生成硫酸锌和氢气,根据氢气质量可以计算硫酸质量和反应生成的硫酸锌质量,进一步可以计算所用硫酸溶液中溶质的质量分数、所得溶液中溶质的质量分数.
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

【题目】下列有关实验现象的描述不正确的是 ( )
A. 红磷在空气中燃烧产生大量白烟 B. 硫在氧气中燃烧产生淡蓝色的火焰
C. 打开浓盐酸瓶盖,瓶口出现大量白雾 D. 氯化铵与熟石灰混合、研磨会嗅到氨味
【题目】将一定量的苯(C6H6)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和一种未知物X;测得反应前后物质的质量如下表:
物质 | 苯 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 3.9 | 9.6 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 6.6 | 2.7 | m |
下列判断正确的是( )
A.表中m的值为13.5
B.该反应属于分解反应
C.物质X能在氧气中燃烧
D.物质X中一定含有氢元素
【题目】对下列事实的微观解释正确的是( )
选项 | 事实 | 解释 |
A | 水结冰后体积变大 | 水分子本身的体积变大 |
B | 液氧是淡蓝色的 | 此时的氧分子是淡蓝色的 |
C | 酒精的水溶液不导电 | 溶液中不存在自由移动的离子 |
D | 有机物的种类繁多 | 原子的核外电子排布方式不同 |
A. A B. B C. C D. D
