题目内容
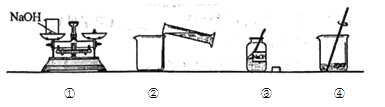
【题目】下列四个图象分别对应四种操作(或治疗)过程,其中正确的是( )
A. 用胃舒平[主要成分
用胃舒平[主要成分![]() ]治疗胃酸过多时pH情况
]治疗胃酸过多时pH情况
B.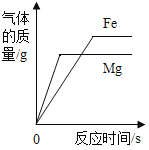 分别向稀盐酸中加入等质量的Fe和Mg
分别向稀盐酸中加入等质量的Fe和Mg
C.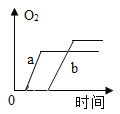 将质量相等的两份药品a和b分别加热,a是混有少量二氧化锰的氯酸,b是纯净的氯酸钾
将质量相等的两份药品a和b分别加热,a是混有少量二氧化锰的氯酸,b是纯净的氯酸钾
D. 在饱和的
在饱和的![]() 溶液中加入
溶液中加入![]() 晶体
晶体
【答案】C
【解析】
胃酸呈酸性,氢氧化铝呈碱性,用氢氧化铝来治疗胃酸过多不能使胃液呈碱性;镁、铁两种金属的活动性顺序为镁>铁,镁和铁都能和稀盐酸反应生成氢气;催化剂只能改变反应速率,不能增加生成物的质量。
A、盐酸和氢氧化铝反应生成氯化铝和水,pH值会有所增大,但是胃必须是酸性环境,所以最后pH仍然小于7,故A不正确;
B、将等质量的Mg和Fe投入到足量稀盐酸中,则铁和镁全部参加反应,等质量的镁和铁与盐酸充分反应后,镁生成的氢气大于铁,故B不正确;
C、a中混有少量二氧化锰的固体氯酸钾,b为固体氯酸钾,且a和b的质量相等,根据二氧化锰作催化剂则可以加快其分解速度,则a反应快,时间短,a中混有二氧化锰,则a中氯酸钾的质量小,则生成的氧气的质量小,故C正确;
D、溶液已经为硝酸钾的饱和溶液,所以再加入硝酸钾也不能溶解,所以溶液中溶质的质量分数不变,故D不正确。故选C。

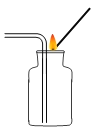
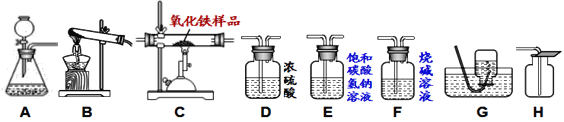
【题目】小杰同学在复习铁生锈条件时知道,常温下,没有氧气,铁与水几乎不反应。老师告诉同学们,高温下,铁与水蒸气能反应生成一种常见的铁的氧化物和一种气体。小杰很好奇,设计如图所示实验探究铁粉与水蒸气反应后的产物。
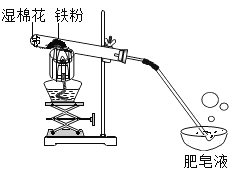
(1)试管尾部放一团湿棉花的目的是___________________。
(2)探究生成的气体是什么?用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是_________________。
(3)探究试管中剩余固体成分是什么?
(查阅资料)常见的铁的氧化物有FeO(黑色、没有磁性)、![]() 、
、![]() 。
。
(初步验证)试管中固体为黑色,能全部被磁铁吸引。
(猜想与假设)猜想一:剩余固体是![]() ;猜想二剩余固体是__________________。
;猜想二剩余固体是__________________。
(实验探究)
实验操作 | 实验现象结论 |
______________________ | ___________________证明猜想一正确 |
(实验结论)铁和水蒸气反应的化学方程式:___________________。
(反思与交流)该黑色固体不可能是![]() ,理由是___________________。
,理由是___________________。