题目内容
【题目】某化学兴趣小组为检验当地石灰石中含碳酸钙的质量分数,在实验直将6g石灰石样品(杂质不参如反应,也不溶解于水)放入盛有19g稀盐酸的烧杯中,恰好完全反应,测得烧杯中物质的总质量为22.8g,求(保留小数点后一位)
(1)生成二氧化碳的质量为_____。
(2)所用稀盐酸的溶质的质量分数?_____
(3)样品中碳酸钙的质量分数。_____
(4)反应后所得溶液的溶质质量分数是多少?_____
【答案】2.2g 19.2% 83.3% 25.5%
【解析】
(1)依据质量守恒可知,之所以残留物的质量减轻,是由于产生了气体,因此减轻的质量就是CO2的质量;
(2)根据二氧化碳的质量,计算出氯化氢的质量,再用氯化氢的质量除以19g乘以百分之百算出;
(3)根据二氧化碳的质量,计算出碳酸钙的质量,再用碳酸钙的质量除以6g乘以百分之百算出;
(4)根据二氧化碳的质量,计算出氯化钙的质量,再用根据溶质质量分数的计算公式计算。
(1)依据质量守恒可知,之所以残留物的质量减轻,是由于产生了气体,因此减轻的质量就是CO2的质量:6g+19g﹣22.8g=2.2g;
(2)设生成2.2g二氧化碳,需要参加反应的碳酸钙质量为x,参加反应的氯化氢质量为y,生成的氯化钙的质量为z,则
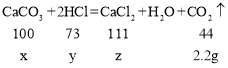
![]()
解得:x=5g,y=3.65g,z=5.55g;
所用盐酸的质量分数为:![]() ×100%≈19.2%。
×100%≈19.2%。
(3)样品中碳酸钙的质量分数是:![]() ≈83.3%。
≈83.3%。
(4)反应后所得溶液的溶质质量分数是:![]() ≈25.5%
≈25.5%

练习册系列答案
相关题目