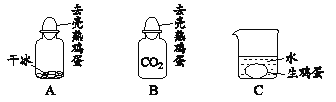
��Ŀ����
����Ŀ��ijѧϰС����������������Һ��ϡ��������кͷ�Ӧʵ��ʱ�����ǵμӷ�̪��Һ����������ȡ��Ӧ�����Һ�������Թ��У������еμ��˼��η�̪��Һ��������ҺΪ��ɫ������ʵ������ͬѧ�ǶԷ�Ӧ������ʳɷ�չ����̽����

��������⡿��Ӧ������ʳɷ���ʲô��
���������ϡ�CaCl2��Һ�����ԡ�
��������롿��ͬѧ�ӷ�Ӧ�����������Һ�г���������̪�⣬���ʿ�������������������� CaCl2���� CaCl2��HCl���� CaCl2��Ca(OH)2
���������ۡ���ͬѧ��ʵ����������ó����������϶����������������� ��
��ʵ��̽������ͬѧȡ��Ӧ�����Һ�����ձ��У���������εμ�ϡ̼������Һ���������ߵα߽��衣ʵ���ó���������������μ�̼������Һ���֮��Ĺ�ϵ������ͼ��ʾ��д��ʵ������е����� ����0-V1������Ҫ������Ӧ�ķ���ʽΪ ��
���ó����ۡ���ͬѧ�IJ����У� ������ţ�������
����˼���ۡ���1��ѧϰС����ͼ�����˱�ͬѧʵ��������ձ�����Һ�ı仯������˵����ȷ���� ������ĸ����
A���Ȼ��Ƶ�������������С B���Ȼ�������������V2��
C. ��Һ���������� D��Na2CO3��Һ���ΪV2ʱ����Һ����NaCl��CaCl2
��2��С��ͬѧ���۷����������ձ�����Һ��pH����Na2CO3��Һ��������Ӷ������ı䣬��������ͼ�а����ǻ��Ƴ�����Na2CO3��Һ�����������ҺpH�ı仯ͼ��

���𰸡����������ۡ��μӷ�̪��Һ��������ҺΪ��ɫ�� ��ʵ��̽������ʼ�������ݲ�������Ӧһ��ʱ�����ְ�ɫ������Na2CO3+2HCL=2NaCl+CO2��+H2O ���ó����ۡ��� ����˼���ۡ���1��C��2��ͼ���PHֵ��С��7��������Ϊ����7.
��������
�����������ͬѧ��ʵ����������ó����������϶����������������ǵμӷ�̪��Һ��������ҺΪ��ɫ������һ�������м��ͼʾ������ʼû�г���������˵���������Ǽ����̼���ƺ�����ķ�Ӧ��Ȼ����̼���ƺ��������Ƶķ�Ӧ�����������ǿ�ʼ�������ݳ��֣�Ȼ�����ְ�ɫ��������0-V1������Ҫ������Ӧ�ķ���ʽΪNa2CO3+2HCL=2NaCl+CO2��+H2O�����Լ�ͬѧ�IJ����У������������ͼ�����˱�ͬѧʵ��������ձ�����Һ�ı仯���Ȼ��Ƶ������������ӣ���̼���ƺ����ᷴӦ��ͻ�����Ȼ��ƺ�̼���Ƶķ�Ӧ����������Ȼ��Ƶ���������٣���0-V1���Ȼ�������������V1�䣻��Һ����������Na2CO3��Һ���ΪV2ʱ����Һ����NaCl�������ձ�����Һ��pH����Na2CO3��Һ��������Ӷ������ı䣬��ʼ�����ᣬ���Կ�ʼ��PHֵ��С��7������Ӧ��̼���ƺ��Ȼ���ʱ�������е�PHֵ�Ǵ�С��7������7����̼���ƺ��Ȼ��Ʒ�Ӧʱ����Һ��PHֵһֱ��7��һֱ��Na2CO3��Һ���ΪV2ʱ�����ټ���̼���ƺ���Һ��PHֵ����7����Ϊ̼���Ƶ���Һ��ʾ���ԡ�