题目内容
镀锌铁片是在铁片上均匀镀上一层锌.某小组为测定10g镀锌铁片上锌的质量,设计方案如图:
(1)步骤Ⅰ中溶解锌的化学方程式为 ,步骤Ⅲ洗涤的目的是为了除去 ,步骤Ⅳ是 ;
(2)利用上述方案进行实验,测定结果偏大,分析原因 .
(3)若将方案中的稀盐酸换成硫酸亚铁溶液,为达到实验目的,写出步骤Ⅰ中的具体操作. .

(1)步骤Ⅰ中溶解锌的化学方程式为
(2)利用上述方案进行实验,测定结果偏大,分析原因
(3)若将方案中的稀盐酸换成硫酸亚铁溶液,为达到实验目的,写出步骤Ⅰ中的具体操作.
考点:金属的化学性质,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:(1)锌与稀盐酸反应生成氯化锌和氢气,方程式为:Zn+2HCl=ZnCl2+H2↑;分离物质获取固体的步骤为:过滤,洗涤,干燥.
(2)实际操作中不容易判断锌层恰好完全被酸溶解,稀盐酸会稍过量,铁与盐酸反应.
(3)锌可以置换硫酸亚铁中的铁,为了促进反应进行,可将镀锌铁片研碎.
(2)实际操作中不容易判断锌层恰好完全被酸溶解,稀盐酸会稍过量,铁与盐酸反应.
(3)锌可以置换硫酸亚铁中的铁,为了促进反应进行,可将镀锌铁片研碎.
解答:解:(1)锌与稀盐酸反应生成氯化锌和氢气,方程式为:Zn+2HCl=ZnCl2+H2↑;加水洗涤的目的是除去铁片表面残留的氯化锌溶液,使结果准确;称量之前需要干燥;
(2)实际操作中不容易判断锌层恰好完全被酸溶解,稀盐酸会稍过量,铁与盐酸反应,反应后称量的铁片的质量会低于实际值.
(3)若将方案中的稀盐酸换成硫酸亚铁溶液,先将镀锌铁片研碎,加入足量的硫酸亚铁溶液,充分反应后溶液颜色仍呈浅绿色
故答案为:(1)Zn+2HCl=ZnCl2+H2↑(1分);铁片表面残留的氯化锌溶液(1分);干燥(其他合理表述也可)(1分)
(2)实际操作中不容易判断锌层恰好完全被酸溶解,稀盐酸会稍过量,铁与盐酸反应,
反应后称量的铁片的质量会低于实际值.(1分)
(3)先将镀锌铁片研碎,加入足量的硫酸亚铁溶液,充分反应后溶液颜色仍呈浅绿色.(1分)(或直接加入硫酸亚铁溶液后不断搅拌、充分振荡也可.)
(2)实际操作中不容易判断锌层恰好完全被酸溶解,稀盐酸会稍过量,铁与盐酸反应,反应后称量的铁片的质量会低于实际值.
(3)若将方案中的稀盐酸换成硫酸亚铁溶液,先将镀锌铁片研碎,加入足量的硫酸亚铁溶液,充分反应后溶液颜色仍呈浅绿色
故答案为:(1)Zn+2HCl=ZnCl2+H2↑(1分);铁片表面残留的氯化锌溶液(1分);干燥(其他合理表述也可)(1分)
(2)实际操作中不容易判断锌层恰好完全被酸溶解,稀盐酸会稍过量,铁与盐酸反应,
反应后称量的铁片的质量会低于实际值.(1分)
(3)先将镀锌铁片研碎,加入足量的硫酸亚铁溶液,充分反应后溶液颜色仍呈浅绿色.(1分)(或直接加入硫酸亚铁溶液后不断搅拌、充分振荡也可.)
点评:本题是一道实验探究题,能较好的考查学生分析和解决问题的能力,考查了常见金属的性质,解答时要依据题干提供信息,结合相关知识细心分析解答.

练习册系列答案
相关题目
日常生活中高钙牛奶中的“钙”是指( )
| A、单质 | B、分子 | C、原子 | D、元素 |
 小明探究二氧化碳的性质做了如下两个实验:
小明探究二氧化碳的性质做了如下两个实验: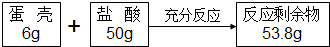
 化学与生活息息相关,请用化学知识回答下列问题.
化学与生活息息相关,请用化学知识回答下列问题.