题目内容
请用“>”、“=”、“<”符号连接:
(1)食盐水的PH=a,碳酸钠溶液的PH=b,则a________b;
(2)Ca(OH)2在20℃的溶解度为ag,50℃的溶解度为bg,则a________b;
(3)生铁中碳元素占a%,钢中碳元素占b%,则a________b;
(4)质量、溶质的质量分数相同的两份稀硫酸分别与足量的氧化铜、氢氧化铜反应,反应生成的硫酸铜的质量分别为ag和bg,则a________b.
解:(1)食盐水显中性,PH等于7,碳酸钠溶液显碱性,PH大于7.故填:<.
(2)因为氢氧化钙的溶解度随着温度的升高而减小,所以Ca(OH)2在20℃的溶解度大于50℃的溶解度.故填:>.
(3)因为生铁中碳元素的质量分数比钢中碳元素的质量分数大.故填:>.
(4)因为氧化铜、氢氧化铜足量,稀硫酸适量,所以反应时生成的硫酸铜的质量决定于硫酸的质量.故填:=.
分析:当溶液的PH等于7时,呈中性.当溶液的PH大于7时,呈碱性.当溶液的PH小于7时,呈酸性.
氢氧化钙的溶解度随着温度的升高而减小.生铁中碳元素的质量分数比钢中碳元素的质量分数大.
质量、溶质的质量分数相同的两份稀硫酸分别与足量的氧化铜、氢氧化铜反应时生成的硫酸铜的质量决定于硫酸的质量.
点评:解答本题的关键是要掌握溶液酸碱性与溶液PH的关系,溶解度与温度的关系,生铁和钢含碳量方面的知识,物质之间反应时的质量之间的关系,只有掌握了这些方面的关系才能对问题做出正确的判断.
(2)因为氢氧化钙的溶解度随着温度的升高而减小,所以Ca(OH)2在20℃的溶解度大于50℃的溶解度.故填:>.
(3)因为生铁中碳元素的质量分数比钢中碳元素的质量分数大.故填:>.
(4)因为氧化铜、氢氧化铜足量,稀硫酸适量,所以反应时生成的硫酸铜的质量决定于硫酸的质量.故填:=.
分析:当溶液的PH等于7时,呈中性.当溶液的PH大于7时,呈碱性.当溶液的PH小于7时,呈酸性.
氢氧化钙的溶解度随着温度的升高而减小.生铁中碳元素的质量分数比钢中碳元素的质量分数大.
质量、溶质的质量分数相同的两份稀硫酸分别与足量的氧化铜、氢氧化铜反应时生成的硫酸铜的质量决定于硫酸的质量.
点评:解答本题的关键是要掌握溶液酸碱性与溶液PH的关系,溶解度与温度的关系,生铁和钢含碳量方面的知识,物质之间反应时的质量之间的关系,只有掌握了这些方面的关系才能对问题做出正确的判断.

练习册系列答案
相关题目
某同学在查阅资料时得知:市售纯碱样品常混有氯化钠杂质.
| 资料卡: 侯氏制碱法的原理可以表示为: NaCl+H2O+NH3+CO2 =NaHCO3↓+NH4Cl 2NaHCO3?Na2CO3+CO2 ↑+H2O该同学设计了如图中的装置进行实验,测定市售纯碱样品中碳酸钠的质量分数.(水蒸气的影响忽略不计,夹持装置已略去) 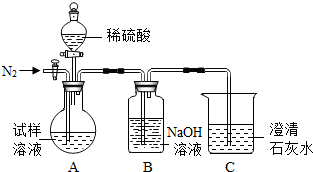 主要实验步骤如下: ①按图组装仪器,并检查装置的气密性; ②称量5.5g市售纯碱样品放入烧瓶中,加适量蒸馏水溶解,得到试样溶液; ③从分液漏斗滴入稀硫酸,直到不再产生气体时为止; ④缓缓鼓入一定量的N2; ⑤称量B瓶及溶液的质量,发现增重2.2g. 请回答下列问题: (1)写出A中发生反应的化学方程式 (2)鼓入一定量的N2的目的是 (3)如果将分液漏斗中的稀硫酸换成浓盐酸,测试的结果(填偏高、偏低或不变) (4)该样品中碳酸钠的质量分数为 (5)若用与上述实验反应原理不同的实验来测定纯碱样品中碳酸钠的质量分数,请用化学方程式表示实验原理 |