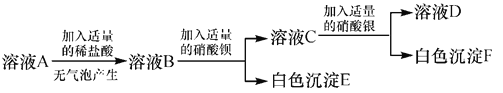
题目内容
【题目】t2℃时,将甲,乙各80g分别放到盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,现象如图一。甲和乙的溶解度曲线如图二。请结合图示回答下列问题:
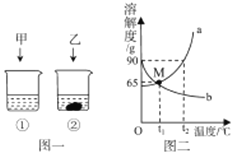
(1)固体甲对应的溶解度曲线是__________ (填“a”或“b”)。
(2)M点的含义______________。
(3)向烧杯①的溶液中继续加入15g甲物质,充分搅拌,发现固体先全部溶解,一段时间后又有部分固体甲析出.你认为“全部溶解”的原因是________________。
(4)将t2℃等质量的甲、乙饱和溶液分别降温到们将t1℃时,所得溶液的有关说法正确的是___________(填字母)。
a.甲溶液仍为饱和溶液 b.两溶液质量甲<乙
c.两溶液中溶剂质量甲=乙 d.两溶液溶质质量甲>乙
【答案】(1)a;(2)t1℃时,甲乙两物质的溶解度相等;(4)abd
【解析】(1)t2℃时,将甲,乙各80g分别放到盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,甲完全溶解,乙有剩余,说明t2℃时,甲的溶解度比乙的大,a为甲的溶解度曲线;(2)在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。故M点的含义是t1℃时,甲乙两物质的溶解度相等;(3)甲的溶解度随温度升高而增大,所以充分搅拌,发现固体先全部溶解,一段时间后又有部分固体甲析出. “全部溶解”的原因是甲溶于水放热,使甲的溶解度增大,降温后因溶解度变小又析出。(4)将t2℃等质量的甲、乙饱和溶液分别降温到们将t1℃时,甲的溶解度碱性析出晶体,得饱和溶液;由于甲析出晶体溶液变少,而乙不析出晶体,溶液的质量不变,所以两溶液质量甲<乙;t2℃时,甲溶解度比乙大,等量两种物质的饱和溶液中,甲溶液溶剂比乙的少;t1℃时,甲 溶解度比乙t2℃时的溶解度大,所以降温都,两溶液溶质质量甲>乙。

【题目】分析处理图表的信息是学习化学的一种重要方法。下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
温度/℃ | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
(1)40 ℃时,氯化钠的溶解度为________g。
(2)碳酸钠的溶解度随温度的升高而________(填“增大”或“减小”)。在20 ℃时,在100 g的水中加入30 g碳酸钠,充分搅拌后得到的是________(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30 ℃,该溶液的溶质质量分数为________(计算结果精确到0.1%)。
(3)10 ℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是________________________________________________________________________。