题目内容
A、D、E为氧化物,B、C为单质,C为紫红色金属.在一定条件下,它们的转化关系如图所示.(反应条件已省去)请回答下列问题:
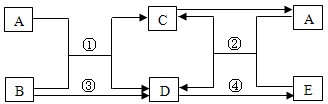
(1)请推断A是 (填化学式);D物质的固体俗名叫: .
(2)反应④ (填“放出”或“吸收”)热量.
(3)写出反应②的化学方程式 .
(4)如果反应③为化合反应,其化学方程式为 .

(1)请推断A是
(2)反应④
(3)写出反应②的化学方程式
(4)如果反应③为化合反应,其化学方程式为
考点:物质的鉴别、推断,化学式的书写及意义,物质发生化学变化时的能量变化,书写化学方程式、文字表达式、电离方程式
专题:框图型推断题
分析:根据题干叙述,本题的解题突破口是C为紫红色金属,则C是铜,由于B是单质,所以A是铜的氧化物--氧化铜.氧化铜A与单质B发生反应之后有单质铜和另一种化合物D生成,则反应①为置换反应;氧化铜与氧化物E发生了化合反应,生成了铜单质,则反应②为氧化还原反应,由此推知E为CO,则C元素来单质B,故B为碳C.碳与氧气发生化合反应③.
解答:解:C为紫红色金属,为铜;
“氧化物A+单质B”反应后有铜单质生成,由质量守恒定律知,Cu元素来自氧化物A,即A是CuO,单质B是具有还原性的非金属单质碳(C),所以由CO+CuO
Cu+CO2推知D为CO2;而CuO+氧化物E→Cu+CO2,则氧化物E为CO;所以反应④的化学反应方程式为:C+CO2
2CO,因为常温破坏C═O需要提供能量,而生成CO的能量不足以补充失去的能量,所以CO2生成CO的反应为吸热反应.所以转换关系为:
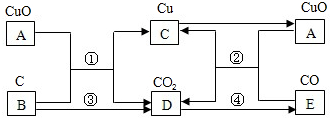
故答案是:
(1)CuO;干冰;
(2)吸收;
(3)CO+CuO
Cu+CO2;
(4)C+O2
CO2.
“氧化物A+单质B”反应后有铜单质生成,由质量守恒定律知,Cu元素来自氧化物A,即A是CuO,单质B是具有还原性的非金属单质碳(C),所以由CO+CuO
| ||
| ||

故答案是:
(1)CuO;干冰;
(2)吸收;
(3)CO+CuO
| ||
(4)C+O2
| ||
点评:本题为框图式物质推断题,完成此题,可以依据题干提供的信息,找准解题突破口,直接得出有关物质的化学式,然后顺推或逆推得出其他物质的化学式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
化学变化伴随能量变化.某同学对碳酸钠、碳酸氢钠与盐酸反应过程中的放、吸热情况进行探究.步骤为:①向试剂1中加入试剂2,搅拌、测温;②再加入试剂3,搅拌、测温.记录数据如下:
则下列说法中,不正确的是( )
| 试剂1 | 试剂2 温度/℃ | 溶解后温度/℃ | 静置后温度/℃ | 试剂3 温度/℃ | 混合后温度/℃ |
| 0.5gNa2CO3 | 10mL H2O 20.0 | 23.3 | 20.0 | 10mL HCl(20%) 20.0 | 23.7 |
| 0.5gNaHCO3 | 10mL H2O 20.0 | 18.5 | 20.0 | 10mL HCl(20%) 20.0 | 20.8 |
| A、物质溶于水的过程也有吸热、放热现象 |
| B、若无步骤②,同样可以达到目的 |
| C、碳酸钠与盐酸反应放出的热量一定比碳酸氢钠反应放出的多 |
| D、若将实验中所用盐酸换成相同浓度的稀硫酸对实验结论没有影响 |
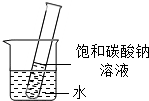 碳酸钠的溶解度随着温度升高而增大20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某种物质后,试管中有晶体析出.
碳酸钠的溶解度随着温度升高而增大20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某种物质后,试管中有晶体析出.