��Ŀ����
����Ŀ��������һ����Ҫ�Ļ�����Ʒ��Ҳ��ʵ��������Ҫ�Ļ�ѧ�Լ�����;�㷺��
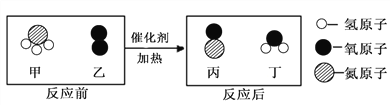
��1������ѹǿ��HCl����̬��ΪҺ̬�����۵ĽǶȷ����ñ仯�����иı����_____________��
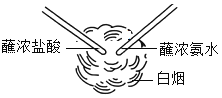
��2��պŨ����IJ�������պŨ��ˮ�IJ������ӽ������Ӵ�����������ͼ������Ӧ�Ļ�ѧ����ʽ��______________��Ũ�����Ũ��ˮ�����лӷ��ԣ������д̼�����ζ��ʴ�ԣ�ʵ��ʱҪע��____________��
��3���۲���ͼ���ش�����:
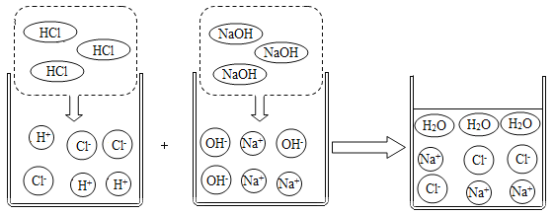
����ͼ��֪��HCl��NaOH�ķ�Ӧʵ����H+ ��OH- ֮��ķ�Ӧ���˷�Ӧ�ɱ�ʾΪ��H++OH-=H2O����������ʵ�ʲ��뷴Ӧ����������ʾ��Ӧ��ʽ�ӳ�Ϊ���ӷ���ʽ���κθ��ֽⷴӦ���������ӷ���ʽ����ʾ��
[��ϰ] ������д��ѧ����ʽ��Ҫ��д�����з�Ӧ�����ӷ���ʽ
HCl��Һ��AgNO3 ��Һ��Ӧ_____________________��
HCl��Һ��Na2CO3��Һ��Ӧ_____________________��
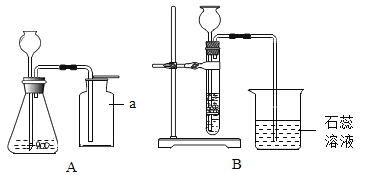
[����] ���ֽⷴӦ��ʵ���ǣ��������ӽ������___________________�ķ�Ӧ��
[Ӧ��] �ж���ˮ��Һ��һ���ܴ����������������___________ ��
A Na+��H+��Cl-��CO32- B H+��Ba2+��Cl-��SO42-
C Cu2+��Na+��NO3-��OH- D H+��K+��Cl-��SO42-
���𰸡����Ӽ�ļ�� NH3+HCl�TNH4Cl ��ȫ��ͨ�� Ag+ + Cl- = AgCl�� 2H+ + CO32- = CO2��+ H2O �����������ˮ D
��������
��1������ѹǿ��HCl����̬ΪҺ̬�����۵ĽǶȷ����ñ仯�����иı�����Ȼ������֮��ļ����С��
��2���������Ȼ��ⷴӦ�������Ȼ�泥���Ӧ�Ļ�ѧ����ʽ�ǣ�NH3+HCl=NH4Cl��Ũ�����Ũ��ˮ�����лӷ��ԣ������д̼��Ժ�ʴ�ԣ�ʵ��ʱҪ��ͨ����н��У�ע�ⰲȫ��ͨ�磮
��3��HCl��Һ��AgNO��Һ��Ӧ�����ӷ���ʽΪ��Ag++Cl-=AgCl��
HNO3��Һ��Na2CO3��Һ��Ӧ�����ӷ���ʽΪ��2H+ + CO32- = CO2��+ H2O��
���ֽⷴӦ��ʵ���ǣ��������ӽ������ˮ�����������ķ�Ӧ��
A�������Ӻ�̼������ӽ������ˮ�Ͷ�����̼����˸�ѡ�����Ӳ��ܹ��棻
B���������ܺ���������ӽ�ϳ����ᱵ��������˸�ѡ��ܹ��棻
C��ͭ���Ӻ����������ӽ�ϳ�������ͭ��������˸�ѡ��ܹ��棻
D������֮�䲻�ܷ�Ӧ����˸�ѡ���ܹ����森