题目内容
在CuO和铁粉的混合物中加入一定量的稀硫酸,反应完全后滤出不溶物,再向滤液中加入一薄铁片,足够时间后,铁片上无任何变化.据此,你认为下列结论不正确的是(提示:CuO+H2SO4![]() CuSO4+H2O)
CuSO4+H2O)
[ ]
A.
滤出的不溶物中有铜,也可能有铁
B.
如果滤出的不溶物中有铁,则一定有铜
C.
滤出的不溶物中一定有铜,但不可能有铁
D.
滤液中一定含有FeSO4,不可能含有CuSO4和H2SO4
答案:C
解析:
解析:
|
解析:根据反应CuO+H2SO4 点评:此题利用金属的有关性质推断生成物,要充分考虑到题给信息的应用,“再向滤液中加入铁片,无现象”的正确应用是避免出错的关键. |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

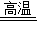 CO+H2. 在120℃、101.3kPa条件下,有H2、N2、CO、CO2和H2O组成的混合气体.将他们依次通过分别放有足量Cu粉、C粉和CuO粉末的三个灼热(800℃左右)的反应管,且不论三个反应管以何种顺序排列,气体通过每个反应管都能充分反应.则:(1)尾气中肯定存在的物质是 ______;
CO+H2. 在120℃、101.3kPa条件下,有H2、N2、CO、CO2和H2O组成的混合气体.将他们依次通过分别放有足量Cu粉、C粉和CuO粉末的三个灼热(800℃左右)的反应管,且不论三个反应管以何种顺序排列,气体通过每个反应管都能充分反应.则:(1)尾气中肯定存在的物质是 ______; CO+H2。在120℃、101.3kPa条件下,有H2、N2、CO、CO2和H2O组成的混合气体。将他们依次通过分别放有足量Cu粉、C粉和CuO粉末的三个灼热(800℃左右)的反应管,且不论三个反应管以何种顺序排列,气体通过每个反应管都能充分反应。则:
CO+H2。在120℃、101.3kPa条件下,有H2、N2、CO、CO2和H2O组成的混合气体。将他们依次通过分别放有足量Cu粉、C粉和CuO粉末的三个灼热(800℃左右)的反应管,且不论三个反应管以何种顺序排列,气体通过每个反应管都能充分反应。则: