题目内容
①一包由FeS、NaH2PO4和MgSO4组成的固体混合物,测知含氧元素质量分数为24%,则该混合物中含铁元素的质量分数为②已知C+H2O
| ||
(2)尾气的组成可能是
分析:①FeS、NaH2PO4和MgSO4仔细观察有点规律:(NaH2PO4)、(MgSO4),可以发现NaH2P的相对原子量和是56,MgS的相对原子量和也是56.可以看成与Fe是等同的;就是说可以把NaH2P、MgS看成是一个整体,就可以通过氧的质量分数求出其含量,余下的就是Fe元素质量分数.
②(1)N2不与Cu粉、C粉和CuO粉末中的任何一个反应;
(2)在120℃、101.3kPa条件下,混合气体依次通过分别放有足量Cu粉、C粉和CuO粉末的三个灼热(800℃左右)的反应管,能发生的反应有:C+CO2
2CO、CuO+H2
Cu+H2O、CuO+CO
Cu+CO2,我们可以据此推断尾气的组成.
②(1)N2不与Cu粉、C粉和CuO粉末中的任何一个反应;
(2)在120℃、101.3kPa条件下,混合气体依次通过分别放有足量Cu粉、C粉和CuO粉末的三个灼热(800℃左右)的反应管,能发生的反应有:C+CO2
| ||
| ||
| ||
解答:解:①因为NaH2P的相对原子量和是56,MgS的相对原子量和也是56.我们就把NaH2PO4和MgSO4,看成FeO4和FeO4.又知氧元素质量分数为24%,所以Fe的质量分数通过计算知:
设铁元素的质量分数为:X
Fe~04
56 64
X 24%
=
X=21%
故答案为:21%
②(1)N2不与Cu粉、C粉和CuO粉末中的任何一个反应,所以尾气中一定有N2.故答案为:N2;
(2)在120℃下,有H2、N2、CO、CO2和H2O组成的混合气体,依次通过分别放有足量Cu粉、C粉和CuO粉末的三个灼热(800℃左右)的反应管,并且充分反应,发生的反应是:C+CO2
2CO、CuO+H2
Cu+H2O、CuO+CO
Cu+CO2,可知尾气中可能是N2、CO2、H2O,故答案为:N2、CO2、H2O.
设铁元素的质量分数为:X
Fe~04
56 64
X 24%
| 56 |
| 64 |
| X |
| 24% |
X=21%
故答案为:21%
②(1)N2不与Cu粉、C粉和CuO粉末中的任何一个反应,所以尾气中一定有N2.故答案为:N2;
(2)在120℃下,有H2、N2、CO、CO2和H2O组成的混合气体,依次通过分别放有足量Cu粉、C粉和CuO粉末的三个灼热(800℃左右)的反应管,并且充分反应,发生的反应是:C+CO2
| ||
| ||
| ||
点评:通过等量代换的技巧,把物质组成中不同的部分因相对原子质量和相等而进行代换,使物质间的组成更具有规律性,方便计算.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
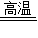 CO+H2. 在120℃、101.3kPa条件下,有H2、N2、CO、CO2和H2O组成的混合气体.将他们依次通过分别放有足量Cu粉、C粉和CuO粉末的三个灼热(800℃左右)的反应管,且不论三个反应管以何种顺序排列,气体通过每个反应管都能充分反应.则:(1)尾气中肯定存在的物质是 ______;
CO+H2. 在120℃、101.3kPa条件下,有H2、N2、CO、CO2和H2O组成的混合气体.将他们依次通过分别放有足量Cu粉、C粉和CuO粉末的三个灼热(800℃左右)的反应管,且不论三个反应管以何种顺序排列,气体通过每个反应管都能充分反应.则:(1)尾气中肯定存在的物质是 ______; CO+H2。在120℃、101.3kPa条件下,有H2、N2、CO、CO2和H2O组成的混合气体。将他们依次通过分别放有足量Cu粉、C粉和CuO粉末的三个灼热(800℃左右)的反应管,且不论三个反应管以何种顺序排列,气体通过每个反应管都能充分反应。则:
CO+H2。在120℃、101.3kPa条件下,有H2、N2、CO、CO2和H2O组成的混合气体。将他们依次通过分别放有足量Cu粉、C粉和CuO粉末的三个灼热(800℃左右)的反应管,且不论三个反应管以何种顺序排列,气体通过每个反应管都能充分反应。则: