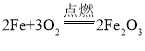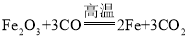题目内容
【题目】某校课外活动小组为了探究化学变化中的质量守恒定律,做了两个探究实验:
问题:研究化学变化中物质质量的变化规律
(1)我的假设:物质发生化学反应前后,其总质量___________________。
(2)我的探究:
实验编号 | 实验一 | 实验二 |
实验装置 |
|
|
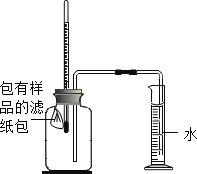
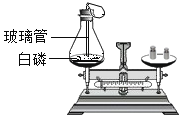
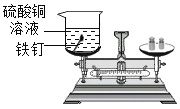
实验操作 | 将如上图所示装置放在天平上称量后取下,将玻璃管烧至红热后,迅速插入锥形瓶中,点燃白磷,并塞紧瓶塞,待反应结束,冷却后,放回托盘天平观察天平。 | 将铁钉和盛有硫酸铜溶液的烧杯一起放在托盘天平上称量后取下,将铁钉浸泡在硫酸铜溶液中一段时间待反应不再继续,再放回托盘天平上,观察天平。 |
化学方程式 | ________ | ________ |
反应前后天平是否平衡 | ________ | __________ |
(3)我的结论:_______________________________________________。
(4)我的解释:_______________________________________________。
【答案】不变(或相等) 4P+5O2![]() 2P2O5 Fe+CuSO4═FeSO4+Cu 平衡 平衡 物质发生化学反应前后,其质量守恒 化学反应的实质是原子发生重新组合的过程,在组合的过程中,原子的种类、原子的数目、原子的质量不变,故化学反应遵循质量守恒定律
2P2O5 Fe+CuSO4═FeSO4+Cu 平衡 平衡 物质发生化学反应前后,其质量守恒 化学反应的实质是原子发生重新组合的过程,在组合的过程中,原子的种类、原子的数目、原子的质量不变,故化学反应遵循质量守恒定律
【解析】
(1)只要是化学变化,都遵循质量守恒定律,所以物质发生化学反应前后,其总质量不变;
(2)我的探究:
实验一:白磷燃烧生成五氧化二磷,在密闭容器中进行反应前后总质量不变,天平平衡;
实验二:铁能与硫酸铜反应生成硫酸亚铁和铜;反应前后总质量不变,天平平衡;
(3)根据上述两个实验,物质发生化学反应前后,其总质量不变,质量守恒;
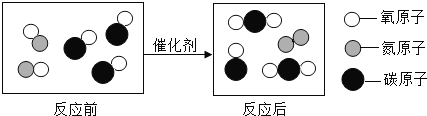
(4)化学反应的实质是原子发生重新组合的过程,在组合的过程中,原子的种类、原子的数目、原子的质量不变,故化学反应遵循质量守恒定律;
答案:(1)不变(或相等);
(2)4P+5O2![]() 2P2O5;Fe+CuSO4═FeSO4+Cu;平衡;平衡;
2P2O5;Fe+CuSO4═FeSO4+Cu;平衡;平衡;
(3)物质发生化学反应前后,其质量守恒;
(4)化学反应的实质是原子发生重新组合的过程,在组合的过程中,原子的种类、原子的数目、原子的质量不变,故化学反应遵循质量守恒定律。

【题目】世界上每年因锈蚀而报废的金属设备和材料高达产量的20%~40%,某实验小组对铁的锈蚀和铁锈的成分进行如下探究。
(一)如图所示,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内水沿着细导管慢慢进入广口瓶。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如表
序号 | 样品 | 量筒起始读数mL | 量筒最终读数mL | 所需时间/min |
① | 1g铁粉、0.2g碳和10滴水 | 100 | 72 | 约120 |
② | 1g铁粉、0.2g碳、10滴水和少量NaCl | 100 | 72 | 约70 |
③ | -- | -- | -- | -- |
(1)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是______(填“放热”或吸热”)过程。
(2)实验①和②说明NaCl可以______(填“加快”或“减慢”)铁锈蚀的速率。
(3)实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成是______。
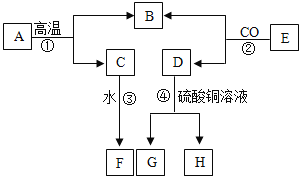
(二)为探究铁锈的成分,用如图所示装置(夹持仪器已省略)进行实验(每步反应和吸收均完全)。
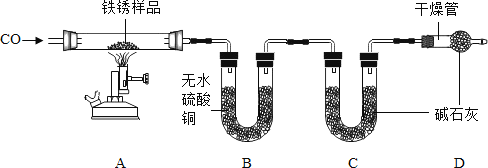
查阅资料:无水硫酸铜吸水会由白色变为蓝色,碱石灰既能吸水也能吸收CO2。
(4)该装置有一个明显缺陷是______。
(5)加热前,先通入CO一段时间,目的是______;将铁锈样品加热,无水硫酸铜逐渐变蓝,由此推知铁锈中一定含有______元素,从而推断出空气中的______参加了铁生锈反应。
(6)若将铁锈的成分表示为FexOynH2O,为了准确测定该成分,除要称量铁锈样品的质量外,还需要测定装置______(填标号)反应前后的质量。若缺少装置D,则测算出的x:y值将______(填“偏大”“偏小”或“无影响”)