题目内容
废铜屑制硫酸铜,小花同学方案为铜与浓硫酸反应,其反应原理是:Cu+2H2SO4(浓)
| ||
| ||
则X是
分析:根据质量守恒定律推断X的化学式;
评价实验方案可从原料消耗(或利用率)和环境污染两个方面去分析.
(1)甲方案:因为发生:Cu+2H2SO4(浓)=CuSO4+2H2O+SO2↑,有二氧化硫生成,会污染空气;
乙方案:2Cu+O2
2CuO;CuO+H2SO4(稀)═CuSO4+H2O,此方案无污染.
(2)分析可知,制取等量的产物,所需硫酸的量不同.
评价实验方案可从原料消耗(或利用率)和环境污染两个方面去分析.
(1)甲方案:因为发生:Cu+2H2SO4(浓)=CuSO4+2H2O+SO2↑,有二氧化硫生成,会污染空气;
乙方案:2Cu+O2
| ||
(2)分析可知,制取等量的产物,所需硫酸的量不同.
解答:解:根据反应前后元素的种类和数目不变,X的化学式为SO2
由反应可知:甲方案:Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑,
乙方案:2Cu+O2
2CuO;CuO+H2SO4(稀)═CuSO4+H2O,
制取相同量的硫酸铜时,方案甲消耗的硫酸比乙的多,并且制取过程中产生了污染大气的有毒气体SO2.
故答为:SO2,小朵;(1)不产生污染性气体,(2)硫酸利用率高;
由反应可知:甲方案:Cu+2H2SO4(浓)
| ||
乙方案:2Cu+O2
| ||
制取相同量的硫酸铜时,方案甲消耗的硫酸比乙的多,并且制取过程中产生了污染大气的有毒气体SO2.
故答为:SO2,小朵;(1)不产生污染性气体,(2)硫酸利用率高;
点评:本题主要考查化学实验的方案设计与评价:了解从原料消耗(或利用率)和环境污染两个方面去分析和评价用废铜制取硫酸铜的两个实验方案.

练习册系列答案
相关题目
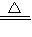 CuSO4+X↑+2H2O.小朵同学方案为:2Cu+O2
CuSO4+X↑+2H2O.小朵同学方案为:2Cu+O2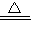 2CuO,CuO+H2SO4=CuSO4+H2O.
2CuO,CuO+H2SO4=CuSO4+H2O. CuSO4+X↑+2H2O.小朵同学方案为:2Cu+O2
CuSO4+X↑+2H2O.小朵同学方案为:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O.
2CuO,CuO+H2SO4=CuSO4+H2O.