题目内容
某兴趣小组的同学探究锰(Mn)、铁(Fe)和铜(Cu)三种金属的活动性顺序.
(1)同学们将锰(Mn)、铜(Cu)两种金属分别放入硫酸亚铁溶液中,发现锰表面有物质生成,而铜表面无现象.则三种金属活动性由强到弱顺序:
(2)兴趣小组的同学从实验室中收集了一桶含有FeSO4、CuSO4的废液.他们想从中回收金属铜和硫酸亚铁晶体,设计了如下方案:
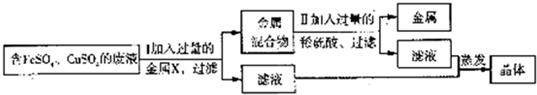
①甲同学提出X可以是铁,乙同学则认为X可以是锰,你认为
②图中“金属混合物”的成分是
③步骤Ⅱ中加入过量稀硫酸的目的是
(1)同学们将锰(Mn)、铜(Cu)两种金属分别放入硫酸亚铁溶液中,发现锰表面有物质生成,而铜表面无现象.则三种金属活动性由强到弱顺序:
锰>铁>铜
锰>铁>铜
.(2)兴趣小组的同学从实验室中收集了一桶含有FeSO4、CuSO4的废液.他们想从中回收金属铜和硫酸亚铁晶体,设计了如下方案:

①甲同学提出X可以是铁,乙同学则认为X可以是锰,你认为
甲
甲
(选填“甲”或“乙”)同学的意见是正确的,理由是加锰会引入新杂质,得不到硫酸亚铁晶体
加锰会引入新杂质,得不到硫酸亚铁晶体
.②图中“金属混合物”的成分是
铁和铜
铁和铜
.③步骤Ⅱ中加入过量稀硫酸的目的是
将金属混合物中的铁除去
将金属混合物中的铁除去
,其中发生反应的化学方程式为Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
.分析:(1)根据金属能与盐溶液反应来比较金属的活动性;
(2)①要除去硫酸亚铁中硫酸铜杂质,根据在除杂时要注意“除去杂质,不引入新的杂质”的原则分析;
②根据加入的X的量及X与硫酸铜的反应分析图中“金属混合物”的成分;
③为了得到纯净的铜,应将混合物中的铁除去,根据反应写出反应的方程式.
(2)①要除去硫酸亚铁中硫酸铜杂质,根据在除杂时要注意“除去杂质,不引入新的杂质”的原则分析;
②根据加入的X的量及X与硫酸铜的反应分析图中“金属混合物”的成分;
③为了得到纯净的铜,应将混合物中的铁除去,根据反应写出反应的方程式.
解答:解:(1)由题意可知,将锰、铜两种金属分别放入硫酸亚铁溶液中,发现锰表面有物质生成,说明了锰的活动性大于铁,而铜表面无现象,说明了铁的活动性大于铜.所以,则三种金属活动性由强到弱顺序是:锰>铁>铜.
(2)①由题意可知,要得到硫酸亚铁晶体,应向FeSO4、CuSO4的废液中加入铁,不加入锰.理由是:加锰会引入新杂质,得不到硫酸亚铁晶体;
②由于加入的铁是过量的,能与硫酸反应生成了铜和硫酸亚铁.所以,“金属混合物”的成分是铁和铜;
③由于金属混合物的成分是铁和铜,要得到铜,应将铁除去.所以,步骤Ⅱ中加入过量稀硫酸的目的是将金属混合物中的铁除去,其中发生反应的化学方程式为Fe+H2SO4=FeSO4+H2↑.
故答为:(1)锰>铁>铜;(2)①甲,加锰会引入新杂质,得不到硫酸亚铁晶体;②铁和铜;③Fe+H2SO4=FeSO4+H2↑.
(2)①由题意可知,要得到硫酸亚铁晶体,应向FeSO4、CuSO4的废液中加入铁,不加入锰.理由是:加锰会引入新杂质,得不到硫酸亚铁晶体;
②由于加入的铁是过量的,能与硫酸反应生成了铜和硫酸亚铁.所以,“金属混合物”的成分是铁和铜;
③由于金属混合物的成分是铁和铜,要得到铜,应将铁除去.所以,步骤Ⅱ中加入过量稀硫酸的目的是将金属混合物中的铁除去,其中发生反应的化学方程式为Fe+H2SO4=FeSO4+H2↑.
故答为:(1)锰>铁>铜;(2)①甲,加锰会引入新杂质,得不到硫酸亚铁晶体;②铁和铜;③Fe+H2SO4=FeSO4+H2↑.
点评:本题主要考查了金属活动性顺序表的应用,难度不大,熟记金属活动性顺表、理解其应用是解答本题的关键.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
(5分)某兴趣小组的同学探究浓硫酸与木炭反应后产生气体的成分。
【查阅资料】经查阅资料得知:
① C与浓H2SO4在加热时反应,有CO2、SO2、H2O生成。
② CO2、SO2均可使澄清石灰水变浑浊。
③ SO2可使品红溶液的红色褪去,而CO2不能。
④ SO2可与酸性的KMnO4溶液反应使其褪色,而CO2不能。
⑤ 无水CuSO4为白色粉末,遇水可生成蓝色的胆矾。
【实验探究】组装成一套完整的实验装置,然后进行实验探究。装置如下: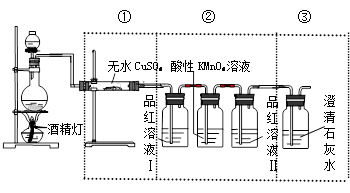
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气 。
(2)根据实验所观察到的实验现象,记录如下
| 实验装置 | ① | ② | ③ |
| 实验现象 | 无水CuSO4变为蓝色 | 品红溶液(I)和酸性高锰酸钾溶液都褪色,品红溶液(Ⅱ)不褪色 | 石灰水变浑浊 |
【实验结论】浓硫酸与木炭反应的化学方程式是 。
【交流讨论】实验结束后,同学们针对本实验进行讨论,其中小芳同学提出了“反应产物中可能还有一氧化碳”这样的一个观点。你是否支持小芳同学的观点? (填“支持”或“不支持”),请你说出理由: 。



