题目内容
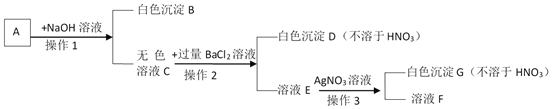
【题目】现有五瓶失去标签的无色溶液,它们分别是稀盐酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液和碳酸钠溶液。探究小组进行如下的分析实验:
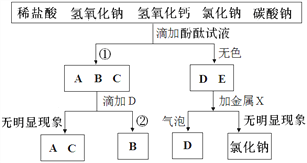
(1)①中的颜色是_______。
(2)“加金属X”产生“气泡”的化学方程式是_______,“金属X”不能是铜的原因是______。
(3)②中观察到的现象是_______。
(4)经研究分析,将第一步实验中的酚酞试液改为_______,就可直接鉴别出D、E。
(5)可以用B试剂来鉴别A与C,请写出操作方法、观察到的实验现象及结论_______。
【答案】 红色 Zn+2HCl=ZnCl2+H2↑ 铜的金属活动性弱不能置换酸中的氢 有气泡产生 石蕊试液 将碳酸钠溶液(即B)分别滴入A、C两种溶液中,若有白色沉淀产生的是氢氧化钙
【解析】(1)酚酞溶液遇中性或酸性溶液不变色,遇碱性溶液变红,所以①中的颜色是红色。(2)D、E中一种物质是HCl,一种物质是NaCl,其中HCl能与金属反应生成氢气而冒气泡,故D是HCl,X是金属活动性顺序中氢前的金属,可以是锌,反应的化学方程式:Zn+2HCl=ZnCl2+H2↑ 。金属活动性顺序中,氢后的金属不能与酸反应生成氢气,铜位于氢后,所以铜不能与盐酸反应。(3) NaOH + HCl == NaCl + H2O,无明显现象;2HCl+ Ca(OH)2 ==CaCl2 +2H2O,无明显现象;Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑,有气泡产生,所以B是Na2CO3,②中观察到的现象是有气泡产生。(4)五种物质中,NaOH溶液、Ca(OH)2溶液、Na2CO3溶液显碱性,能使石蕊溶液变蓝,HCl显酸性,能使石蕊溶液变红,NaCl溶液显中性,不能使石蕊溶液变色,所以将第一步实验中的酚酞试液改为石蕊溶液,就可直接鉴别出HCl、NaCl。(5)A与C,是NaOH、Ca(OH)2中的物质,B是Na2CO3,Na2CO3溶液与NaOH溶液不反应,无现象,与Ca(OH)2溶液反应生成白色沉淀,所以用Na2CO3溶液就可以鉴别出NaOH溶液、Ca(OH)2溶液。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案