题目内容
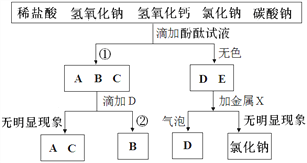
【题目】一包白色固体中可能含有氯化钠、硫酸铜、硫酸镁、硝酸钡中的一种或多种,加水溶解得到无色溶液A,某化学兴趣小组按如下流程继续进行实验检验原白色固体成分。
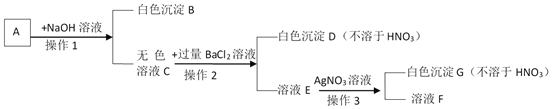
①操作1的名称为_____,用到的主要玻璃仪器为_____;
②白色沉淀B的化学式为_____;
③溶液E中一定含有的溶质是_____;
④白色固体组成情况为_____。
【答案】 过滤 漏斗、烧杯、玻璃棒 Mg(OH)2 氯化钡、氯化钠 ①硫酸镁; ②硫酸镁、氯化钠;
【解析】(1)几种物质加水溶解后得到无色溶液A,说明原混合物中一定没有硫酸铜,加入氢氧化钠后有白色沉淀生成,说明原混合物中一定有硫酸镁,则一定没有硝酸钡,操作1是将固液分离的过程,故是过滤,该操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗;
(2)加入氢氧化钡后有白色沉淀生成,生成的沉淀只能是氢氧化镁,化学式为Mg(OH)2,
(3)向溶液E中加入硝酸银,有不溶于硝酸的白色沉淀生成,说明原溶液中一定有氯化钠,故E溶液中一定有氯化钠和过量的氯化钡;
(4)由上分析,原混合物中有硫酸镁、氯化钠;

 导学全程练创优训练系列答案
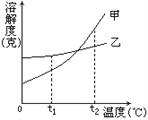
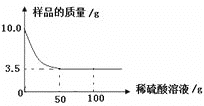
导学全程练创优训练系列答案【题目】NH4Cl和Na2SO4的溶解度表及溶解度曲线如图.下列说法错误的是( )

温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
A. 乙为NH4Cl
B. t3应介于40℃﹣50℃
C. 55℃时,分别将两饱和溶液蒸发等质量的水,得到固体质量甲>乙
D. 等质量的甲、乙饱和溶液从t3降温到t1,析出的晶体质量相等
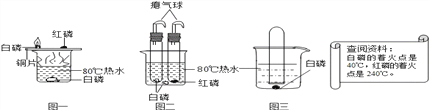
【题目】某同学对CaH2的制备和性质进行探究。
【阅读资料】①用H2与钙加热制得CaH2 ②钙遇水立即发生剧烈反应生成一种碱和一种气体 ③CaH2要密封保存,遇水反应也生成一种碱和一种气体
【CaH2的制备】设计的制取装置如图所示.
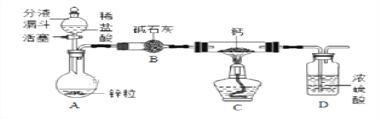
(1)装置B的作用是____________________________;
(2)制备CaH2实验结束后,取少量产物,小心加入水中,观察有气泡产生,在溶液中滴入石蕊试液后显__________色。该同学据此判断:实验中确有氢化钙生成,其他同学提出结论不一定正确,原因是________________________。
【CaH2的性质探究】取少量上述制得的CaH2 样品加入到足量的碳酸钠溶液中,产生大量气泡,过滤,得到滤渣和滤液。经检验滤渣的成分是碳酸钙。该同学进行了如下的探究。
(3)点燃产生的气体,火焰淡蓝色;将燃烧产物通入澄清石灰水中,无现象。则该气体为_________(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH猜想二:NaOH、Ca(OH)2 猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因___________________
【实验验证】
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量 Na2CO3溶液 | ____________ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | ________________ | 猜想三成立 |
【定量分析】
取制得的CaH2样品1g(杂质为未反应完的Ca)加入到足量的Na2CO3溶液中,充分反应后,过滤、洗涤、干燥称得CaCO3质量为2.4g,则该样品中CaH2的质量分数为__________(写出计算过程).