题目内容
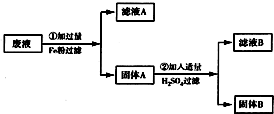 某化工厂排除的废液中含有少量的CuSO4 和 FeSO4,为了防止污染环境,回收利用,将废液进行如下处理,如图所示.请回答:
某化工厂排除的废液中含有少量的CuSO4 和 FeSO4,为了防止污染环境,回收利用,将废液进行如下处理,如图所示.请回答:(1)滤液A和滤液B中含有相同的溶质名称是
硫酸亚铁
硫酸亚铁
.(2)固体A与固体B中含有相同的物质是
Cu
Cu
.(填化学式)(3)分离固体A中的物质,可以用一种最简单的物理方法是
磁铁吸出铁粉
磁铁吸出铁粉
.(4)步骤①和②发生的化学反应属于
置换
置换
反应.(5)写出步骤①或②反应中的一个化学方程式
Fe+CuSO4═Cu+FeSO4 或 Fe+H2SO4═H2↑+FeSO4
Fe+CuSO4═Cu+FeSO4 或 Fe+H2SO4═H2↑+FeSO4
.分析:依据金属活动性顺序表的意义解决,活动性排在前面的金属可以把活动性比它弱的金属从其盐溶液中置换出来,氢前金属能与酸反应放出氢气,据此分析即可;
解答:解:由于铁的活动性比铜强,所以铁可以置换出硫酸铜中的铜同时生成硫酸亚铁,所以滤液A中含有的溶质是硫酸亚铁,固体A中含有的金属是剩余的铁和置换出的铜,固体A加入硫酸后铜的活动性在氢后铁在氢前,所以铁可以与硫酸反应生成硫酸亚铁,而铜不能,因此滤液B中含有硫酸亚铁,固体B是铜,另外金属铁能被磁铁吸引而铜不能,①和②过程发生的反应方程式为:Fe+CuSO4═Cu+FeSO4 和 Fe+H2SO4═H2↑+FeSO4,两者均是一种单质与一种化合物反应生成一种单质与一种化合物,是置换反应.
故答案为:(1)硫酸亚铁(2)Cu.(3)磁铁吸出铁粉.(4)置换.(5)Fe+CuSO4═Cu+FeSO4 或 Fe+H2SO4═H2↑+FeSO4.
故答案为:(1)硫酸亚铁(2)Cu.(3)磁铁吸出铁粉.(4)置换.(5)Fe+CuSO4═Cu+FeSO4 或 Fe+H2SO4═H2↑+FeSO4.
点评:此题是对物质回收分离的考察题,解题的关键是充分的利用金属活动性顺序的意义,属基础性知识考查题.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
为检测某化工厂排放的废液中是否含有S042﹣,同学们设计了如下方案,并进行了实验.
| 方案 | 步骤 | 现象 | 结论 |
| Ⅰ | ①取样品.滴加BaCl2溶液 ②对步骤①反应后的混合物进行过滤,在滤渣中滴加稀盐酸 | ①有白色沉淀产生 ②无明显现象 | 废液中含有S042﹣ |
| Ⅱ | ①取样品,滴加过量 稀盐酸 ②在步骤①的溶液中滴加BaCl2溶液 | ①无明显现象 ②有白色沉淀产生 | 废液中含有SO42﹣ |
| Ⅲ | ①取样品,滴加Ba(N03)2溶液 ②对步骤①产生的混合物进行过滤,在滤渣中滴加稀硝酸 | ①有白色沉淀产生 ②无明显现象 | 废液中含有S042﹣ |
(1)方案Ⅱ的实验结论如果正确,步骤①中滴加的物质是 .
(2)方案Ⅰ和Ⅲ中,结论不成立的方案是 ,理由是 .
(3)方案Ⅲ的滤渣中,滴加稀硝酸是为了排除 的干扰.
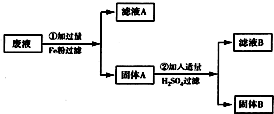 某化工厂排除的废液中含有少量的CuSO4 和 FeSO4,为了防止污染环境,回收利用,将废液进行如下处理,如图所示.请回答:
某化工厂排除的废液中含有少量的CuSO4 和 FeSO4,为了防止污染环境,回收利用,将废液进行如下处理,如图所示.请回答: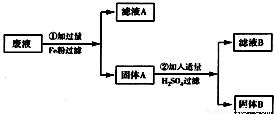 某化工厂排除的废液中含有少量的CuSO4 和 FeSO4,为了防止污染环境,回收利用,将废液进行如下处理,如图所示.请回答:
某化工厂排除的废液中含有少量的CuSO4 和 FeSO4,为了防止污染环境,回收利用,将废液进行如下处理,如图所示.请回答: