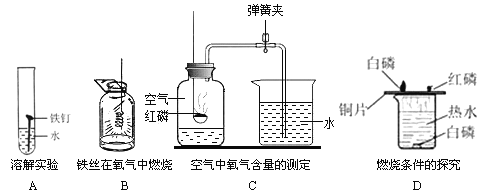
题目内容
【题目】如图是对四个实验绘制的图形,其中实验结果与对应图形正确的是
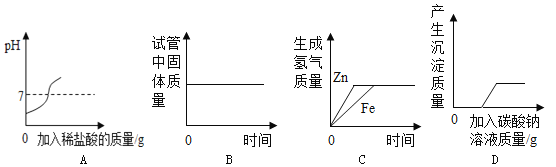
A.向pH=13的氢氧化钠溶液中加入稀盐酸
B.在试管中加热高锰酸钾
C.等质量的锌粉和铁粉与足量的稀硫酸反应
D.向含有HCl和CaCl2的混合溶液中加入Na2CO3溶液
【答案】D
【解析】
试题分析:解答图像类的题目抓住“三点一走势”,即首先看清楚横、纵坐标各表示的量,然后从起始点、转折点、终点还有量的变化趋势来进行分析解答,A、向pH=13的氢氧化钠溶液中加入稀盐酸,反应刚开始显碱性,PH大于7,然后随着盐酸的不断加入,氢氧化钠不断被消耗,故碱性不断减弱,直至盐酸过量,PH小于7,错误,B、在试管中加热高锰酸钾,由于反应生成气体氧气,故试管中剩余的固体质量应减少,错误,C、等质量的锌粉和铁粉与足量的稀硫酸反应,根据化学反应:Zn + H2SO4 === ZnSO4 + H2↑,Fe + H2SO4 == FeSO4 + H2↑中Zn、Fe与氢气的质量关系,可知最终产生的氢气质量不相等,错误,D、向一定量的稀盐酸和CaCl2混合溶液中滴入Na2CO3 溶液,先发生反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑,然后再发生反应:CaCl2+Na2CO3==CaCO3↓+2NaCl,故生成沉淀的质量不是从0开始,正确,故选D

练习册系列答案
相关题目