题目内容
生铁和钢都是铁合金,生铁中碳的含量在2.0%~4.3%之间,钢中碳的含量在0.03%~2.0%之间.将一块质量为10.0g的铁合金放入锥形瓶中,再向锥形瓶中加入100g稀H2SO4,恰好使铁合金中的铁完全反应(碳不溶于稀H2SO4;铁合金中其他元素含量很低,可忽略不计),测得生成H2的体积为4.00L(H2在该条件下的密度为0.0880g/L).
试根据计算回答:(计算结果保留三位有效数字)
(1)该铁合金是生铁还是钢?
(2)反应后所得溶液的溶质质量分数.
解:(1)设该铁合金中铁的质量为x
氢气的质量=4.00L×0.0880g/L=0.352g
Fe+H2SO4=FeSO4+H2↑
56 2
X 0.352g
X=9.856g
该铁合金中碳的质量分数=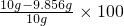 %=1.44%,介于0.03%~2.0%之间,该铁合金是钢
%=1.44%,介于0.03%~2.0%之间,该铁合金是钢
(2)设反应后所得溶液中溶质的质量为y
Fe+H2SO4=FeSO4+H2↑
152 2
y 0.352g
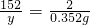
y=26.75g
所得溶液中溶质的质量分数= %=24.4%
%=24.4%
答:(1)该铁合金是钢.
(2)所得溶液中溶质的质量分数为24.4%.
分析:(1)根据氢气的质量求出铁的质量,进而求出碳的质量,求出铁合金中碳的质量分数,根据生铁中碳的质量分数和钢中碳的质量分数判断是生铁还是钢.
(2)所得溶液中溶质的质量分数= %,根据氢气的质量求出所得溶液中溶质即硫酸亚铁的质量,所得溶液的质量=铁的质量+稀硫酸的质量-氢气的质量.
%,根据氢气的质量求出所得溶液中溶质即硫酸亚铁的质量,所得溶液的质量=铁的质量+稀硫酸的质量-氢气的质量.
点评:有关反应后所得溶液质量的计算是初中化学计算的一个重点内容,反应后所得溶液的质量一般等于所加入的所有物质的质量总和-生成气体的质量-生成沉淀的质量.
氢气的质量=4.00L×0.0880g/L=0.352g
Fe+H2SO4=FeSO4+H2↑
56 2
X 0.352g
X=9.856g
该铁合金中碳的质量分数=
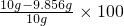 %=1.44%,介于0.03%~2.0%之间,该铁合金是钢
%=1.44%,介于0.03%~2.0%之间,该铁合金是钢(2)设反应后所得溶液中溶质的质量为y
Fe+H2SO4=FeSO4+H2↑
152 2
y 0.352g
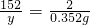
y=26.75g
所得溶液中溶质的质量分数=
 %=24.4%
%=24.4%答:(1)该铁合金是钢.
(2)所得溶液中溶质的质量分数为24.4%.
分析:(1)根据氢气的质量求出铁的质量,进而求出碳的质量,求出铁合金中碳的质量分数,根据生铁中碳的质量分数和钢中碳的质量分数判断是生铁还是钢.
(2)所得溶液中溶质的质量分数=
 %,根据氢气的质量求出所得溶液中溶质即硫酸亚铁的质量,所得溶液的质量=铁的质量+稀硫酸的质量-氢气的质量.
%,根据氢气的质量求出所得溶液中溶质即硫酸亚铁的质量,所得溶液的质量=铁的质量+稀硫酸的质量-氢气的质量.点评:有关反应后所得溶液质量的计算是初中化学计算的一个重点内容,反应后所得溶液的质量一般等于所加入的所有物质的质量总和-生成气体的质量-生成沉淀的质量.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、生铁和钢都是铁合金 | B、纯铁质软 | C、合金有很多优越性能,因此应用很广泛 | D、合金是由几种金属混合而成 |
 钢铁是使用最多的金属材料.
钢铁是使用最多的金属材料.