��Ŀ����
����Ŀ����ͼ�е�����Ϊ���л�ѧ�������ʣ�����֮��ķ�Ӧ��ϵ��ͼ��ʾ(��������ʾת����ϵ����������ʾ��ܷ�Ӧ�����ַ�Ӧ��������Ӧ��������ȥ)���˵�θҺ�к���������A�ɰ���������A��B�����кͷ�Ӧ������֮һ�dz����ڳ��õĵ�ζƷ��C�����ڸ�������������DΪ̼���Σ���C����Һ��D����Һ��Ӧ�ɵõ�B��F��G�ڳ����¶�Ϊ���壮��ش�

(1)A�Ļ�ѧʽ��_____��D��������________��
(2)��ͨ��һ��ʵ��֤��A��B�Ƿ�ǡ����ȫ��Ӧ����Ҫ��A��B��Ӧ�����Һ�м�����Լ���_________��
(3)E��C��Ӧ�Ļ�ѧ����ʽ��____________��
G��F��Ӧ�Ļ�ѧ����ʽ��______
(4)ͼ�и������ת����û���漰�Ļ�����Ӧ������ _________________ ��
���𰸡� HCl ������մ� ��ɫʯ����Һ CaO+H2O===Ca(OH)2 6CO2+6H2O![]() C6H12O6+6O2 �û���Ӧ
C6H12O6+6O2 �û���Ӧ
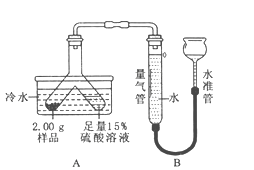
���������˵�θҺ�к�������������ɰ�����������AΪHCl��A��B�����кͷ�Ӧ������֮һ�dz����ڳ��õĵ�ζƷ��BΪ����ɵ�����ΪNaCl����BΪNaOH��C�����ڸ���������������CΪ�������ƣ�DΪ̼���Σ�������������Һ��D����Һ��Ӧ�ɵõ�NaOH����DΪ̼���ƣ�ϡ�����ܺ�ijЩ���ʷ�Ӧ����ˮ���������ƺͶ�����̼��Ӧ����̼���ƺ�ˮ���������ƺͶ�����̼��Ӧ����̼��ƺ�ˮ��ˮ�������Ʒ�Ӧ�����������ƣ���֪EΪˮ��F��G�ڳ����¶�Ϊ���壬���̼���ƺ��ᷴӦ������CO2���壬ˮ����������������������GΪCO2��FΪO2��
(1)�ɷ�����֪AΪ�Ȼ��⣬�仯ѧʽ��HCl��DΪ̼���ƣ��������Ǵ�����մ�
(2�����NaOH��ȫ�к�ʱ��Һ�����ԣ�����������Һ�����ԣ�NaOH�������Һ�Լ��ԣ���Ӧ�����Һ�м�����ɫʯ����Һ������ҺΪ��ɫ����˵����Ӧǡ����ȫ��
(3)��ˮ�����������Ʒ�����Ӧ�Ļ�ѧ����ʽ��CaO+H2O===Ca(OH)2��
CO2����O2������Ӧ�Ļ�ѧ����ʽ��6CO2+6H2O![]() C6H12O6+6O2��
C6H12O6+6O2��
(4)ͼ��E��C�������Ϸ�Ӧ��A��E�������ֽⷴӦ��E��F��ͨ�����ˮ�����ֽⷴӦ����û���漰���Ļ�����Ӧ�������û���Ӧ��

����Ŀ����ѧС�����ˮ���ײ�ˮ������Ҫ�ɷֽ���������̽������ش����⡣
���������ϡ���Ȼˮ�к���Ca2+��Mg2+��HCO3�������ӣ��ڼ��������£���Щ�������������ܽ�ȸ�С�����ʡ���ˮ��(��Ҫ�ɷ�Ϊ̼���κͼ�)���й����ʵ��ܽ��Լ��±���

��������롿ˮ������Ҫ�ɷ���һ������______��_________(�ѧʽ)�����ܺ���Ca(OH)2��MgCO3��
����Ʒ����� ʵ�飱��ȷ��ˮ�����Ƿ�Ca(OH)2��CaCO3
ʵ�鲽�� | ʵ������ | ���� |
�����������ˮ���м�������������ˮ��ֽ��裬���ˣ�����Һ�м���Na2CO3��Һ�� | û�а�ɫ�������� | һ������ Ca(OH)2 ��һ���� CaCO3 |
ʵ��2��ȷ��ˮ�����Ƿ�MgCO3
��������ʵ��װ�ã����ʵ��2̽��������Ҫʵ�鲽�����£�
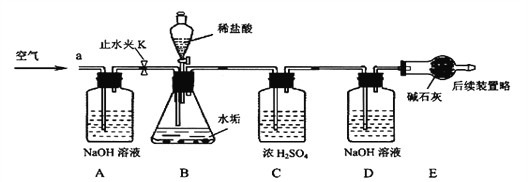
����D��Eװ��������Ϊ600.00g������ͼ��װ��2.50gˮ������������ƿ�У���������ϡ������Һ������ƿ�в��ٲ�������ʱ����ֹˮ��K���ӵ���a���������������һ��ʱ������װ��D��E��������Ϊ601.25g(��ʯ����Ҫ�ɷ�ΪCaO��NaOH��������װ���ڿ�����ʵ���Ӱ��)��
��ʵ�����ۡ���1��������ƷǰӦ_______________________________��
��2����Ӧ�������ֹˮ��K���������������Ŀ����_______________________��װ��A��������________________________________ ��
��3��A��Bװ��֮��_____���ø���װ��(���Ҫ����Ҫ��)��������_____________��
��4��װ��B������CO2������Ϊ______g��ͨ������˵��ˮ����_____��MgCO3(����ĸ)��
A. һ�� B. һ���� C. ���� D. ��ȷ��
ʵ��3��ȷ��ˮ�����Ƿ���Mg(OH)2
��5����ȡ����Ϊ2.50g��ˮ��������3.65%��ϡ������֮��Ӧ���������ϡ����w g���������ʵ����ۣ��ж�w��ֵ����________________����ʱ��ˮ����һ������Mg(OH)2��