题目内容
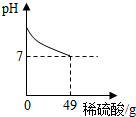 (2012?淮北模拟)酸和碱发生中和反应,它在日常生活和农业生产中有着广泛的应用.小强同学在做中和反应实验时,向盛有40克10%氢氧化钠溶液的烧杯中逐滴加入稀硫酸,滴加过程如图所示,求所加稀硫酸的溶质质量分数.
(2012?淮北模拟)酸和碱发生中和反应,它在日常生活和农业生产中有着广泛的应用.小强同学在做中和反应实验时,向盛有40克10%氢氧化钠溶液的烧杯中逐滴加入稀硫酸,滴加过程如图所示,求所加稀硫酸的溶质质量分数.分析:根据题意,当溶液的pH等于7时,氢氧化钠溶液与稀硫酸恰好完全反应,此时消耗稀硫酸的质量为49g;根据40克10%氢氧化钠溶液中溶质的质量由反应的化学方程式列式计算出参加反应的稀硫酸中溶质的质量,进而可计算出所加稀硫酸的溶质质量分数.
解答:解:当溶液的pH等于7时,氢氧化钠溶液与稀硫酸恰好完全反应,此时消耗稀硫酸的质量为49g;
40克10%氢氧化钠溶液中溶质的质量为40g×10%=4g,
设所加稀硫酸中溶质的质量为x,
2NaOH+H2SO4=Na2SO4+2H2O
80 98
4g x
=
x=4.9g
所加稀硫酸的溶质质量分数=
×100%=10%.
答:所加稀硫酸的溶质质量分数为10%.
40克10%氢氧化钠溶液中溶质的质量为40g×10%=4g,
设所加稀硫酸中溶质的质量为x,
2NaOH+H2SO4=Na2SO4+2H2O
80 98
4g x
| 80 |
| 98 |
| 4g |
| x |
所加稀硫酸的溶质质量分数=
| 4.9g |
| 49g |
答:所加稀硫酸的溶质质量分数为10%.
点评:本题难度不是很大,理解图形分析反应的进程、分析图象中所给数据的含义、正确的运用有关数据解决问题是解答此类题目的关键所在.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目

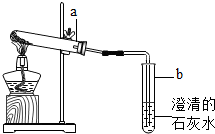 (2012?淮北模拟)小明对妈妈买来的一包焙制糕点、面包的发酵粉发生兴趣,他拆开发酵粉包装,里面有两小袋白色粉末:一袋是碳酸氢钠(NaHCO3),另一袋是酒石酸(C4H6O3).妈妈告诉小明烤制面包的方法:将加有两种粉末的面团揉和均匀后,放在烤箱中烘烤,就可制成疏松多孔的面包.下面是小明探究这种发酵粉的过程,请你完成相应的填空:
(2012?淮北模拟)小明对妈妈买来的一包焙制糕点、面包的发酵粉发生兴趣,他拆开发酵粉包装,里面有两小袋白色粉末:一袋是碳酸氢钠(NaHCO3),另一袋是酒石酸(C4H6O3).妈妈告诉小明烤制面包的方法:将加有两种粉末的面团揉和均匀后,放在烤箱中烘烤,就可制成疏松多孔的面包.下面是小明探究这种发酵粉的过程,请你完成相应的填空: