题目内容
【题目】某化学兴趣小组为了測定粗锌中锌的质量分数,在10g粗锌中分5次共加入50.0g稀硫酸(杂质不与硫酸反应),部分数据如下表。
容器中硫酸的质量/g | 10 | 20 | 40 | 50 |
气体质量/g | 0.1 | 0.2 | m | 0.3 |
根据实验数据回答下列问题:
(1)当硫酸滴入40g时,对应的气体质量m是_______g。
(2)粗锌中锌的质量分数是多少?__________________
【答案】0.3 97.5%
【解析】
根据表格数据分析可知,每次加入10g稀硫酸,完全反应能产生0.1g氢气,加入50g稀硫酸,产生的氢气的质量为0.3g,若能完全反应,产生的氢气质量应为0.5g,而实际上产生的氢气的质量为0.3g,进行分析解答。
解:(1)由表格数据分析可知,每次加入10g稀硫酸,完全反应能产生0.1g氢气,加入50g稀硫酸,若能完全反应,产生的氢气质量应为0.5g,而实际上产生的氢气的质量为0.3g,说明加入30g稀硫酸时,恰好完全反应;则加入40g稀硫酸,稀硫酸有剩余,则对应的气体质量m是0.3g;
(2)设粗锌中锌的质量为x,
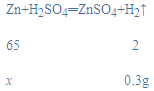
![]()
x=9.75g,
粗锌中锌的质量分数是![]() ×100%═97.5%;
×100%═97.5%;
答:(1)当硫酸滴入40g时,对应的气体质量m是0.3g;
(2)粗锌中锌的质量分数是97.5%。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
【题目】![]() 合金广泛用于制造机械零件。为测定某
合金广泛用于制造机械零件。为测定某![]() 合金粉中锌的含量,分别取20g该粉末用下列两种方法测定(其他成分均不参与反应)。
合金粉中锌的含量,分别取20g该粉末用下列两种方法测定(其他成分均不参与反应)。
加入试剂 | 测定数据 | |
方法一 | 足量稀硫酸 | 氢气的质量0.2g |
方法二 | 足量的硫酸铜溶液 | 固体减少0.1g |
请任选一种方法,计算![]() 合金粉中锌的质量分数,写出计算过程及结果。
合金粉中锌的质量分数,写出计算过程及结果。