题目内容
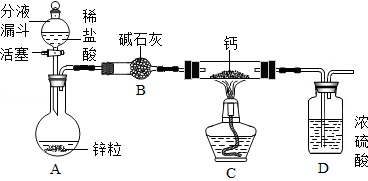
(10分)为探究气体X的组成,某兴趣小组进行图12所示实验(固定装置未画出)。
【资料在线】
(1)加热条件下,气体X能与氧化铜反应生成铜、水和氮气。
(2)碱石灰为固体氢氧化钠和氧化钙的混合物,不与气体X反应。
无水氯化钙可吸收气体X。
(3)本实验条件下,氮气密度为1.15g·L-1,装置内空气中的水与二氧化碳对相关数据测定的影响可忽略不计。
【实验步骤】
(1)连接仪器,并检查装置气密性。
(2)取一定量氧化铜,准确称得其质量为2.40g。
(3)按图12所示装入药品,测量并记录相关数据Ⅰ(见表1)。
(4)连接A、B、C装置, 将气体X缓缓通入一段时间后,连接上D装置,读数后开始加热。当A装置中氧化铜反应完全,停止加热,继续通入气体 X至玻璃管冷却,再次测量并记录相关数据Ⅱ(见表1)。
【实验装置】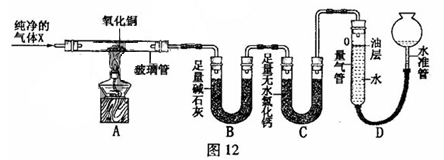
【相关数据】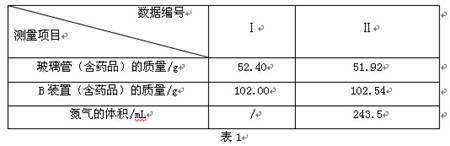
【回答问题】
(1)B装置中氧化钙吸水的原理为 (用化学方程式表示)。
(2)实验过程中,当观察到 ,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃管冷却的目的是 。
(3)分析实验测量的数据,生成水的质量为 g,氧化铜中氧元素的质量为 g。
由此推知,气体X中一定 (填“有”或 “没有”)氧元素。
(4)通过计算推导出气体X的化学式。
(1)CaO+H2O==Ca(OH)2 (2)量气管内液面不再下降 防止灼热的铜被氧化
(3)0.54 0. 48 没有 (4)NH3
解析试题分析:(1)氧化钙吸水是因为氧化可与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O==Ca(OH)2
(2)根据资料在线中的内容可知:因气体X可与氧化铜在加热的条件反应生成铜、水蒸气和氮气;当所有的气体通过B装置时,水蒸气被吸收;再通过C装置时,多余的X气体被吸收;则进入D装置内的气体为反应生成的氮气。随着氮气进入D装置,可造成其中的气体增多,气压变大,会观察到液面下降。所以当观察到量气管内液面不再下降时,说明不再生成氮气,即可说明氧化铜已反应完全。继续能入气体X是防止灼热的铜与其它物质反应而被氧化。
(3)根据上面的分析,结合表1可知:装置B的作用是吸收生成的水,所以装置B的质量增加值则为生成水的质量;即102.54g—102.00g=0.54g。在玻璃管中原为氧化铜,反应结束后其成分为铜单质, 所以其质量减少值则为氧化铜中氧元素的质量,即为52. 40g—51.92g= 0.48g(也可根据氧化铜的质量求出氧元素的质量)。进一步可根据装置B测出的水的质量,结合水的化学式(H2O),可求出其中氧元素的质量为:0.54g×(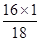 )=0.48g。二者求出的氧元素的质量相同,可说明在气体X中没有氧元素。
)=0.48g。二者求出的氧元素的质量相同,可说明在气体X中没有氧元素。
(4)根据上述分析可知该气体中只含氮元素和氢元素,且可根据氮气的质量求出其中氮元素的质量;可根据生成水的质量求出其中氢元素的质量。然后可根据氮元素与氢元素的质量比求出气体中氮氢元素的原子个数比,即可确定其化学式。具体计算过程如下:
解:设该气体的化学式为NxHy,根据题意可知:
14x:1y=(0.2435L×1.15g/L):(0.54g—0.48g)
x:y=1:3
所以该气体的化学式为NH3
考点: 实验方案的设计与评价、根据化学式的计算

 阅读快车系列答案
阅读快车系列答案研究性学习小组测定实验室里一瓶久置的NaOH固体是否变质.
【提出问题】NaOH固体是否变质?
【猜想与假设】猜想1:没变质,全部是NaOH;
猜想2:全变质,全部是Na2CO3
猜想3:部分变质,既含有NaOH,又含有Na2CO3;
【设计方案并进行实验】请你与他们一起完成,并回答所给问题.
| 实验步骤 | 实验现象 | 实验结论 |
| ①称取上述固体样品8g溶于100mL水配成溶液,向溶液中滴加 过量的氯化钙溶液充分反应后,静置. | _________ | 说明久置固体中,一定含有Na2CO3 |
| ②用玻璃棒蘸取少量①中的上层清液滴在pH试纸上,与标准比色卡对比,测出pH | pH=10 | 说明固体中,还一定含有 _________ (填化学式). |
【实验结论】通过实验,说明上述猜想中 _________ 是正确的.
【拓展】
(1)为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、干燥,称得其质量为2g,则固体样品中NaOH的质量分数为 _________ (假定试剂中无其它杂质).
(2)要除去氢氧化钠中含有的碳酸钠,所用的方法(用化学方程式表示) _________
【反思】通过探究,实验室中的氢氧化钠应密封保存.
(7分)实验是科学探究的重要方法。如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题。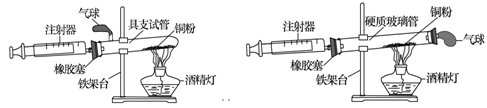
装置一 装置二
(1)根据下表提供的实验数据,完成下表
| 硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 25mL | 15mL | 9mL | |
(3)若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举两条) ; 。
(8分)常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。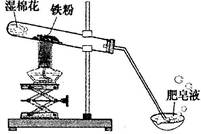
(1)试管尾部放一团湿棉花的目的是_______________。
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。 说明生成的气体是______________。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________。
【实验探究】
| 实验操作 | 实验现象及结论 |
| | |
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________。