题目内容
【题目】兴趣小组同学发现实验室一片久置的铜片表面附着有一层绿色固体,查阅资料得知绿色固体是铜绿 [化学式为Cu2(OH)2CO3],能与稀硫酸反应产生硫酸铜、水和二氧化碳,加热产生氧化铜、水和二氧化碳。下面是小组同学回收铜的实验流程: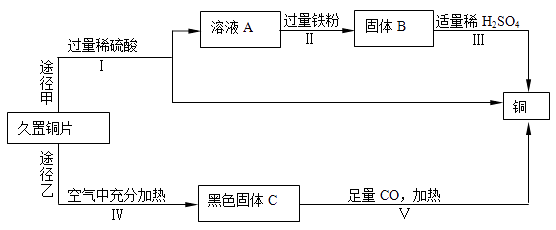
回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ都需要进行过滤的操作,过滤用到的玻璃仪器是烧杯、玻璃棒和。溶液A所含的溶质有(填化学式)
(2)写出下列反应的化学方程式:步骤Ⅲ , 步骤Ⅴ。
(3)同一久置铜片分别通过途径甲和途径乙最终得到的铜的质量是:途径甲(选填“大于”、“等于”或“小于”)途径乙。
(4)途径甲比途径乙更好的理由是(答一点)。
【答案】
(1)漏斗,H2SO4、CuSO4
(2)Fe+H2SO4=FeSO4+H2↑,CO+CuO ![]() Cu+CO2
Cu+CO2
(3)等于
(4)不用加热更节能
【解析】(1)过滤用到的玻璃仪器是烧杯、玻璃棒和漏斗铜绿 [化学式为Cu2(OH)2CO3],能与稀硫酸反应产生硫酸铜、水和二氧化碳;溶液A所含的溶质有CuSO4和过量的H2SO4。(2)步骤Ⅲ是过量的铁与H2SO4的反应即Fe+H2SO4=FeSO4+H2↑;加热产生氧化铜、水和二氧化碳, 故黑色固体C为CuO,即CO+CuO ![]() Cu+CO2 (3)质量守恒定律知产生铜的质量相等。(4)更节能。
Cu+CO2 (3)质量守恒定律知产生铜的质量相等。(4)更节能。
所以答案是:漏斗;H2SO4、CuSO4;Fe+H2SO4=FeSO4+H2↑;CO+CuO ![]() Cu+CO2;等于;不用加热更节能。
Cu+CO2;等于;不用加热更节能。
【考点精析】根据题目的已知条件,利用金属的回收利用及其重要性的相关知识可以得到问题的答案,需要掌握金属回收的意义:节约金属资源,减少环境污染.

练习册系列答案
相关题目