题目内容
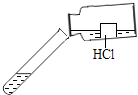
【题目】A、B、C、D、E、F、G为常见的物质,其中B、E、G属于单质,反应②是炼铁工业中的主要反应,它们之间的相互转化关系如图所示:
(1)A物质的化学式 .
(2)写出反应②的化学方程式;C物质的固态在实际生活中的一种用途是;
(3)写出反应③中生成红色固体的化学方程式;如图转化中产生无色气体G的原因是 .
(4)写出物质G和A反应的化学方程式 .
【答案】
(1)CuO
(2)Fe2O3+3CO ![]() 2Fe+3CO2,人工降雨
2Fe+3CO2,人工降雨
(3)CuCl2+Fe=FeCl2+Cu,过量的稀盐酸和铁反应生成了氢气
(4)CuO+H2 ![]() Cu+H2O
Cu+H2O
【解析】(1)A物质是氧化铜,氧化铜的化学式是CuO;
(2)反应②中,氧化铁和一氧化碳反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO ![]() 2Fe+3CO2;C物质是二氧化碳,二氧化碳的固态在实际生活中的一种用途是用于人工降雨;
2Fe+3CO2;C物质是二氧化碳,二氧化碳的固态在实际生活中的一种用途是用于人工降雨;
(3)反应③中生成红色固体的反应是:氯化铜和铁反应生成氯化亚铁和铜,反应的化学方程式为:CuCl2+Fe=FeCl2+Cu;如图转化中产生无色气体氢气的原因是过量的稀盐酸和铁反应生成了氢气;
(4)G是氢气,A是氧化铜,加热条件下,氢气和氧化铜反应生成铜和水,反应的化学方程式为:CuO+H2 ![]() Cu+H2O.
Cu+H2O.
故答案为:(1)CuO;(2)Fe2O3+3CO![]() 2Fe+3CO2;人工降雨;(3)CuCl2+Fe=FeCl2+Cu;过量的稀盐酸和铁反应生成了氢气;(4)CuO+H2
2Fe+3CO2;人工降雨;(3)CuCl2+Fe=FeCl2+Cu;过量的稀盐酸和铁反应生成了氢气;(4)CuO+H2![]() Cu+H2O.
Cu+H2O.
炼铁时,氧化铁和一氧化碳在高温条件下反应生成铁和二氧化碳;铜是红色固体,它和氧气在加热条件下反应生成氧化铜,氧化铜和稀盐酸反应生成氯化铜和水,氯化铜和铁反应生成氯化亚铁和铜,铁和稀盐酸反应生成氯化亚铁和氢气;氧化铜和氢气在加热条件下反应生成铜和水,因此ABCDEFG分别是氧化铜、铁、二氧化碳、氧化铁、铜、氯化亚铁和氢气;据此分析解答即可.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】能源、环境问题是保证我国可持续发展的关键,请回答下列问题:
(1)现在,我国还是以化石燃料为主要能源获得能量,常见的化石燃料包括煤、和天然气等.它们属于再生能源(填“可”或“不可”).
(2)化学反应也可用来获得能量,下列反应过程中会放出热量的是 (填答案序号)
A.生石灰与水
B.碳与二氧化碳
C.镁与盐酸
(3)为减少环境污染、提高煤的利用率,可将其转化为可燃性气体,此过程可认为是碳与水的反应,其微观示意图如图所示:该反应的化学方程式为 , 基本反应类型为 . 
(4)为了减少环境污染和温室气体,人们努力减少对化石燃料的依赖.经研究发现NH3燃烧的产物也没有污染,且释放大量能量,作为燃料它在某些方面还优于H2 .
①将NH3燃烧反应的化学方程式补充完整:4NH3+3O2 ![]() 6H2O+ .
6H2O+ .
②请根据下表信息分析用NH3取代H2的优点:
颜色、气味 | 熔点(℃) | 沸点(℃) | 常温时,1L水中能溶解的气体体积 | 标况下密度 (g/L) | |
NH3 | 无色、刺激性 | ﹣77.7 | ﹣33 | 700L | 0.6942 |
H2 | 无色、无味 | ﹣259.2 | ﹣253 | 0.017L | 0.0899 |
由于NH3比H2沸点高,所以更易 , 便于储存和运输.NH3泄漏时易发现是因为 , 同时它易溶于水,便于处理.